表的内容
是什么农杆菌属?
农杆菌属是一种植物病原体,通过伤口部位感染植物,导致冠瘿病,是迄今为止在农业中使用的最流行的植物转化工具之一。
- 农杆菌属农是利用其IV型细菌分泌系统将其转移的(T)-DNA转移到宿主细胞的土壤病原体。
- 属农杆菌属根据疾病症状和宿主范围的不同,由不同的物种组成。的一些物种农杆菌属包括一个.放射杆菌、葡萄球菌、发根杆菌、红球菌而且农.
- 本属的生物最著名的是作为植物转化工具在广泛的宿主细胞中使用。
- 细菌的寄主范围是由不同的细菌和植物因素决定的。细菌因子包括毒力基因和T-DNA致癌基因,而植物因子包括转化和肿瘤形成所需的基因。
- 细菌的自然多样性是基于主要致病决定因素Ti/Ri质粒的存在而确定的。
- 不同菌株的农杆菌属可从世界各地广泛分离出寄主植物。一些常见的寄主植物包括玫瑰、杨树、榕树、菊花和其他果树。
- 不同质粒的存在和生物体将具有肿瘤诱导质粒的DNA片段转移到宿主细胞基因组的能力是使用的主要因素农杆菌属在植物转换。
- 农杆菌属为革兰氏阴性棒状菌,长1.5 ~ 3 μ m,宽0.6 ~ 1.0 μ m。这种细菌是可运动的,有一条或多达六条鞭毛。
- 它们不形成孢子,是居住在土壤中的严格好氧生物,具有临床和生物技术应用。
影响因素农杆菌属,介导的基因转移
- 有许多方法被用来获得转基因植物,其中一些包括农杆菌属-介导转化、粒子轰击、聚乙二醇介导的原生质体和脂质体介导的转化。
- 在所有这些方法中,农杆菌属-介导的转化导致单拷贝转基因,相对而言,其表达比多基因拷贝更稳定。
- 然而,这一过程受到不同因素的影响,如菌株和细胞密度、植物种类、植物生长调节剂和环境因素。
- 为了开发一个有效的转换协议,有必要找到这些因素的正确组合。
以下是一些影响因素农杆菌属介导的转换;
一个外植体。
- 外植体是培养的目标材料农杆菌属-介导的转化,可以是胚胎培养物,未成熟胚胎,成熟种子衍生物,叶片,甚至茎段。
- 外植体的选择应保证转基因植株的整体恢复。
- 为了确定有效转化过程的最佳外植体,已经进行了不同的研究。
- 从成熟种子中获得的胚胎愈伤组织被认为是最好的外植体之一农杆菌属在某些植物物种中的-介导转化。
- 研究发现,外植体在转化前后的干燥是促进转化的重要因素之一农杆菌属感染。
- 在不同的植物组织上的转化效率的差异被归因于细菌附着在植物细胞上的能力的差异和T-DNA转移机制的差异。
b。外植体受伤
- 外植体的损伤是有效的农杆菌属介导的转换。
- 损伤的类型和方法可以从外植体准备过程中的简单损伤到颗粒枪介导的微损伤。
- 还有其他形式的伤害包括农杆菌属-填充注射器和超声波。
- 目标组织表面和次表层微损伤的形成也会促进转化,从而导致酚类化合物的释放。
- 转化的效率还取决于附加酚类物质的应用。
c.植物种类和基因型
- 效率的差异农杆菌属-介导转化在不同植物物种中是由于诱导分子的差异。
- 转化的成功取决于染色体和质粒基因组,它们编码所有附着和DNA转移所需的物质。
- 不同植物在不同寄主中vir基因的表达水平不同,这影响了病毒对感染的敏感性农杆菌属.
- 即使在同一物种内,几个栽培品种或生态类型对肿瘤的发生表现出不同程度的敏感性农杆菌属物种。
- 大部分的农杆菌属-介导的基因转移在双子叶植物上进行,但近年来,单子叶植物的基因转移频率有所增加。
d。抗生素
- 在转化过程中,先共培养,然后抑制细菌,以免干扰寄主植物的生长发育。
- 细菌的消灭是通过在培养基中使用一种或多种抗生素来实现的。
- 一些常用的抗生素是卡苯西林和头孢噻肟。使用抗生素的类型也取决于植物的种类和农杆菌属菌株。
- 确定正确的抗生素配比对实现抗生素的选择和适当的肿瘤发生率至关重要。
e.植物生长调节剂(PGR)
- 植物转化也需要添加植物生长调节剂,而调节剂的正确选择是影响这一过程的重要因素之一。
- 能力和敏感性农杆菌属在没有PGR治疗的情况下,顽固外植体的感染是低的或没有的。
- 在共培养过程中,生长培养基中2,4- d的存在可以提高转化效率。
- 生长调节剂的使用促进了许多组织中的细胞分裂和分化;然而,调节剂的使用应该在植物细胞周期的特定阶段进行。
光f。
- 光是影响效率的一个重要因素农杆菌属光介导的转化会影响植物中不同的生理因素,如植物激素水平、细胞增殖和细胞周期阶段。
- 光也被认为可以增加酚vir基因诱导剂的数量,这影响转化过程,因为它调节T-DNA转移。
- 各种各样的农杆菌属-介导转化过程利用暗共培养条件来改善外植体的形态。
- 一些研究也表明,光对这一过程的影响主要是基于光周期。
g。温度
- 早期的研究与效率有关农杆菌属表明高温不利于肿瘤的发展。
- 由于病毒A基因的构象变化,已知32°C左右的温度会抑制肿瘤的发展。T-DNA转移的最佳温度为19℃。
- 对于不同的植物来说,转移的最佳温度可能不同,但对许多植物物种来说,19°C到22°C的温度范围是理想的。
h。农杆菌属菌株
- 不同的感染能力农杆菌属菌株是不同的取决于存在不同的质粒。
- 用于转化的最有效的细菌群是超级毒菌株中的标准二元载体和普通菌株中的超级二元载体的组合。
- 不同的组合农杆菌属菌株可用于不同种类的植物细胞。
的原则农杆菌属介导的基因转移
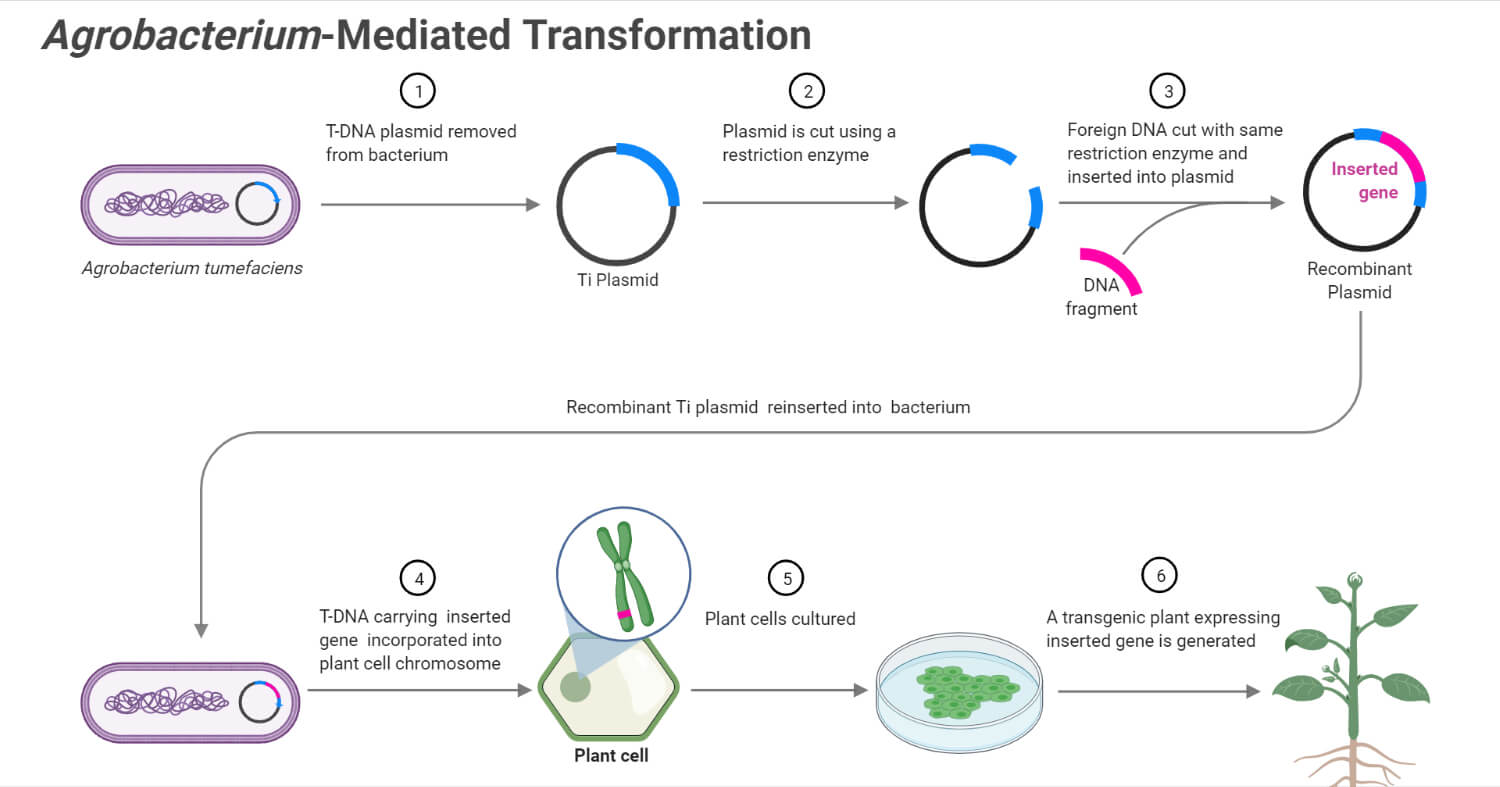
- 的基础农杆菌属-介导转化是生物体将其T-DNA有效地转移到宿主细胞的能力。
- 这一过程的生物学原理包括两个部分;T-DNA由25个bp的重复序列组成,终止于t区和由7个主要位点组成的毒力区(vir)。
- 的机制农杆菌属-介导转化是基于细菌在感染期间将一段质粒转移到植物细胞中。
- 然后,质粒整合到核基因组中,以表达自己的基因,并影响宿主细胞中的激素平衡。
- 除此之外,细菌还会产生大量的酶,这些酶参与了合成酸,然后被细菌用作营养物质。
- 参与感染的细菌的一些基本成分是T-DNA,存在于称为Ti(肿瘤诱导)质粒上,以及其他功能成分,如毒性(vir),结合(con)和起源复制(ori)。
- 感染开始于细菌通过受伤部位进入。受伤的植物细胞释放酚乙酰丁香酮(AS),增强了细菌与植物细胞的结合。
- AS激活细菌上的VirA蛋白,后者通过其天冬氨酸残基的磷酸化来激活VirG。
- 激活的VirG与其他vir基因结合,诱导它们的表达。这个过程激活的VirD刺激t链的生成(T-DNA的单链副本)。
- VirD2共价结合到t链的5 '端,因为在转移过程中5 '端是先导端。其他因子如VirE2和VirB蛋白也与t链结合,形成t复合体。
- 复合物然后通过Vir蛋白释放的核靶信号进入细胞核。T-DNA链被随机整合到植物基因组中,要么是一个副本,要么是多个副本。
- 整合通常通过重组过程发生在基因组的转录活性区或重复区。
- 尽管我们对T-DNA转移的分子生物学了解甚多农杆菌属在细胞中,关于参与这一过程的植物编码因子所知甚少。
要求(材料和试剂)
材料/设备
- 无菌50毫升塑料管
- 高压灭菌器
- 25°C, 16/8小时明暗交替的组织培养室
- 瓶孵化器
- 真空泵
- 用于组织培养的层流罩
- 玻璃器皿(烧杯,圆筒,培养皿,杜兰瓶和烧瓶)
- 滤纸
- 保鲜膜
- 钳和手术刀
- 吸量管
- 离心机
- 分光光度计
- 组织培养器皿
- 手术刀片
试剂
- 外植体(茎、胚、子叶或其他组织)
- 农杆菌属应变
- 13%次氯酸钠
- B5培养基
- 琼脂
- 胰蛋白胨
- 酵母提取物
- 氯化钠
- 35%的盐酸
- 无菌蒸馏水
- 75%的乙醇
- 蔗糖
- 脱落酸
- 利福平
- 卡那霉素monosulfate
- 结冷胶枪粉
- PCR引物星Mix
- 羧苄青霉素二钠盐
媒体准备农杆菌属介导的基因转移
a. LB介质用于农杆菌属文化
- 5克酵母提取物,10克色氨酸,5克氯化钠溶解在1升蒸馏水中。
- 在50 ml LB培养基中,加入100 mg/ml利福平原液50µl和50 mg/ml卡那霉素原液50µl。
b. Murashige和Skoog种子萌发培养基
- 在1升蒸馏水中加入4.43克Murashige和Skoog基础中冲剂和3克蔗糖。
- 在此基础上,加入2.5克结冷粉并进行蒸压。25毫升这种介质在层流下倒在培养皿上。
c。共培养培养基
- 在Murashige和Skoog基础培养基中添加750µl的2mg /ml BAP。同样,将500 μ l的2mg/ml ABA添加到培养基中。
- 25毫升的培养基在层流中倒入无菌的培养皿中。
d。拍摄中
- 共培养培养基中加入50µl的50 mg/ml卡那霉素和2.5 ml的200 mg/ml卡苄青霉素,制备出打靶培养基。
e。生根培养基
- 在生根培养基中加入50µl的50 mg/ml卡那霉素和1 ml的200 mg/ml卡苄青霉素。
程序或协议农杆菌属介导的基因转移
的协议或程序农杆菌属-介导的转化可能会因过程中选择的外植体类型而不同。下面是协议农杆菌属-介导的胚胎转化;
a.种子的灭菌和发芽
- 种子用氯杀菌2然后将种子放入皮氏培养皿中,在室温下浸泡2小时。
- 用镊子从种子上取下种皮,用75%乙醇进一步消毒30秒。然后用20毫升3%次氯酸钠冲洗。
- 将灭菌后的种子放在含有种子萌发培养基的培养皿上,在28°C的黑暗环境下孵育2天。每个盘子可以装15-25粒种子。
b。剂制备
- 2毫升含有利福平和卡那霉素的LB培养基用单个接种农杆菌属殖民地。然后将培养物在28°C的摇床培养箱中培养。
- 的农杆菌属制备好的培养液在4000g离心10分钟。除去上清液,用1ml MS液体培养基清洗小球。
c.外植体的制备
- 种子从萌发培养基中取出,放在有一叠滤纸的空无菌培养皿上。
- 胚根被除去,种子被切去1 / 2的子叶和内膜。
- 用无菌手术刀将子叶分离并擦拭掉。将分离的子叶收集到无菌玻璃烧杯中的MS液体培养基中。
- 将含有子叶的MS液体培养基倒入含有子叶的MS液体培养基中农杆菌属轻轻地和动摇。
- 玻璃烧杯盖上容器,用薄膜密封,放入与真空泵相连的干燥器中。
- 2次真空浸润后,外植体置于培养基上5分钟。
- 将无菌滤纸包装在共培养培养基上,用镊子将感染的外植体放在滤纸上。子叶的正面要保持向上。
- 然后将培养皿密封,在28°C的黑暗中孵育2天。
d。拍摄起始
- 然后将外植体转移到含有卡那霉素和卡青霉素的培养培养基中,以抑制农杆菌属.
- 每个平板可容纳5-6个外植体,然后在25°C光照下培养2-3周。
e。再生
- 一旦外植体上开始出现芽,这些芽就被拔出来,放在无菌的培养皿上,上面有一叠滤纸。
- 用无菌手术刀将嫩枝切下,并切除嫩枝的胚状部分。
- 然后将芽转移到100毫升的玻璃烧瓶或有生根培养基的组织培养容器中。
- 每个容器可以加3-4个嫩枝。容器在25°C光照下孵育1-2周。
- 2周后,如果未观察到根系,则将展开的叶片和嫩枝的末端部分剪掉,并将嫩枝转移到新的生根培养基上。
f。植物适应环境
- 在根开始出现后,将烧瓶上的盖子松开,在25°C下进一步培养3天。
- 然后把植物从培养基中取出,用流水冲洗掉。
- 然后将它们转移到装满湿堆肥并浇水的花盆中。
- 罐子上盖着拉链袋以保持水分。在25°C光照下培养1-2周。
- 一旦植物长得很好,就把拉链袋拿掉,给植物浇水。
的应用农杆菌属介导的基因转移
的一些重要应用农杆菌属介导的转换;
- 的农杆菌介导转化已被用作对植物进行基因改造的一种方法,用于生产各种物质,如蛋白质、抗体,甚至疫苗。
- 不同的植物也被改造以生产救命的药品,如抗凝血剂、人类表皮生长因子和干扰素。
- 用农杆菌属作为生物监测仪,可检测环境中有毒化合物的存在,并为受污染的土壤和水解毒。
- 农杆菌属-介导的转化也通过改变植物的货架期和生物合成显著提高了作物产量。
- 植物可以改良以增强对生物和非生物因素的耐受性,营养捕获增加害虫的抵抗力。
- 农杆菌属-介导转化已被用于生产抗虫作物,通过合并各种有毒基因,如Bt毒素基因。
- 抗虫害能力的提高导致有害农药和除草剂的使用减少。
- 农杆菌属-介导转化是一种较不复杂的基因工程技术,有可能升级用于其他生物。
限制的农杆菌属介导的基因转移
尽管农杆菌属-介导的转换在过去的几年里取得了很大的成功,但该技术也存在一些问题和局限性。该技术经常遇到的一些限制和问题是;
- 与这种技术相关的最重要的限制是宿主范围狭窄,因为它仍然局限于特定的植物物种。
- 尽管人们对细菌中T-DNA转移的机制已经有了很多了解,但对于影响这一过程效率的植物编码因子却知之甚少。
- 这项技术是劳动密集型的,因为它需要制定植物再生协议和详细耗时的过程。许多这些过程容易在体外发生变化,导致不利的结果。
- 单克隆的成功转化取决于胚胎作为外植体的使用;然而,这些只能在一年中很短的一段时间内使用。
- 农杆菌属-介导的转化不能将大的DNA分子转移到经济上更重要的植物中,这表明可能引入了一种强大的载体系统。
参考文献
- G. Sivanandhan, **am, C. Vasudevan, V. Vasudevan。et al。影响因素农杆菌属介导的转型Hybanthusenneaspermus(l)f . Muell . .生物科技植物》代表10,49-60(2016)。https://doi.org/10.1007/s11816-016-0385-8
- 欧腾·L.,伯尔·T., Szegedi E. (2008)农杆菌属一种致病细菌。见:Tzfira T., Citovsky V.(编)农杆菌属:从生物学到生物技术。施普林格,纽约,纽约。https://doi.org/10.1007/978-0-387-72290-0_1
- Gelvin, Stanton b。”农杆菌属-介导的植物转化:“基因操纵”工具背后的生物学。微生物学和分子生物学综述:MMBR卷67,1(2003):16-37,目录。doi: 10.1128 / mmbr.67.1.16 - 37.2003
- 黄,Hau-Hsuan等。农杆菌属介导的植物转化:生物学和应用。拟南芥的书15 e0186卷。。2017年10月20日,doi:10.1199/tab.0186
- Nester, Eugene w。”农杆菌属:大自然的基因工程师。”植物科学前沿卷,730。2015年1月6日,doi:10.3389/fpls.2014.00730
- 李伟,郭国刚,郑国刚。农杆菌属-中介转换:技术现状和未来展望。Chin.Sci.Bull。45岁的1537 - 1546(2000)。https://doi.org/10.1007/BF02886209
- 琼斯,H. d, Doherty, a .和吴h农杆菌属小麦的-介导转化。工厂方法1,5(2005)。https://doi.org/10.1186/1746-4811-1-5
- Alicja Ziemienowicz。农杆菌属介导植物转化:因素、应用和最新进展。生物催化与农业生物技术“,”第三卷,第四期。2014.页95 - 102。https://doi.org/10.1016/j.bcab.2013.10.004.
- Risha Amilia Pratiwi和Muhammad Imam Surya(2020年4月26日)。农杆菌属-介导转化与作物的遗传转化,杜建英,DOI: 10.5772/ IntechOpen .91132。可以从:https://www.intechopen.com/books/genetic-transformation-in-crops/农杆菌属介导转化
- Ziemienowicz, a(2014)。农杆菌介导的植物转化:因子、应用及最新进展。生物催化与农业生物技术,3(4),95-102。doi: 10.1016 / j.bcab.2013.10.004
- 张振贤,李欣,马思等。一个协议农杆菌属黄瓜(黄瓜sativus L.)从子叶外植体的-介导转化,2017年9月19日,协议(版本1)可在协议交换[https://doi.org/10.1038/protex.2017.107]
- Karami O(2008)。影响因素农杆菌属-介导的植物转化。转基因植物。2008年9月。

