目录
抗体是什么?
抗体通常被称为免疫球蛋白(免疫蛋白)。
抗体,又称y型免疫球蛋白,是血液中发现的一种蛋白质,有助于对抗抗原这种外来物质。抗原,通常是蛋白质或多糖,刺激免疫系统产生抗体。抗体使抗原失活,并帮助将其从体内移除。虽然抗原可能是病原菌和病毒感染的来源,但来自内部或环境的有害有机分子也作为抗原。基因工程和各种突变机制的使用允许构建大量抗体(每一种抗体都有独特的基因序列)。
抗体都是y形的,在y的上分支有差异。每个抗体的氨基酸结构上的差异使单个抗体能够识别抗原。抗原表面有一个结合位点,抗体可以从其y形结构臂上的结合位点识别出来。作为对召唤它的抗原的反应,抗体将它的两个结合位点像“锁”一样包裹在抗原结合位点的“钥匙”上,从而摧毁抗原。
抗体的作用方式因不同类型的抗原而异。由于其双臂y形结构,该抗体可以用每只手臂同时攻击两种抗原。如果抗原是由引起白喉或破伤风等感染的致病菌产生的毒素,抗体的结合过程将使抗原的毒素失效。当抗体包围一种病毒(比如引起流感的病毒)时,它会阻止病毒进入其他身体细胞。抗体的另一种作用方式是唤起一组在所谓的血浆补体系统中运作的免疫制剂的帮助。首先,抗体会覆盖感染细菌,然后白细胞会吞噬细菌,摧毁它们,然后将它们从身体中移除。
有五种不同的抗体类型,每一种都有不同的y形结构和功能。它们是IgG, IgA, IgM, IgD和IgE抗体。
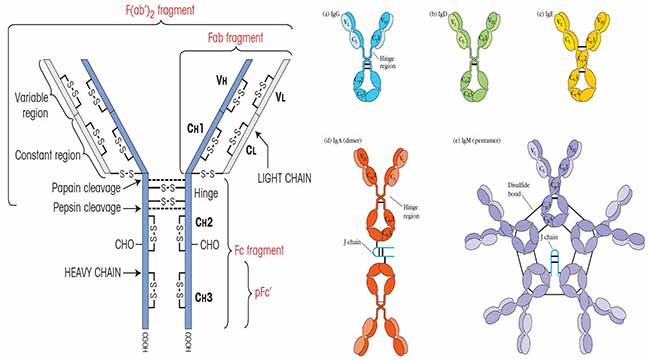
图像来源:库比免疫学第7版。
抗体(免疫球蛋白)的结构
所有抗体分子均有相同的基本结构特征,但在结合抗原的区域中显示出显着的变异性。
重链和轻链都由氨基端组成变量(V)地区参与抗原识别和羧基末端常数(C)地区;重链的C区介导效应函数。
重链和轻链
抗体分子具有由两个相同分子组成的对称核心结构轻链子和两个相同的重链.轻链和重链都包含一系列重复的同源单元,每个单元长度约为110个氨基酸残基,独立折叠成一个被称为Ig域的球状基序。
在里面重链,V Region.由一个Ig域组成,而C地区是由三到四个Ig域组成的。
每一个轻链由一个组成V Region.Ig域和1C地区Ig域。轻链的n端半部分被称为可变区,或VL,轻链区域,而序列的较小可变部分被称为常数区,或CL,区域。两个主要的轻链常数区序列被称为K (kappa)或λ (λ)链.随着产生更多的轻链序列,显而易见的是,λ链恒定区序列可以进一步细分为四种亚型-λ1,λ2,λ3和λ4 - 基于几个位置的氨基酸取代。
在人类中,轻链相当均匀地分布在两个轻链类之间;60%的人类轻链是kappa,而只有40%是lambda。在老鼠身上,情况就大不相同了:只有5%的老鼠轻链是lambda轻链类型。所有轻链的分子量约为22 kDa。
可变区如此命名,因为它们的氨基酸序列在不同B细胞克隆制成的抗体中变化。这V Region.一个重链(VH)和毗邻的V Region.一个轻链(VL)形成抗原结合位点。因为每种抗体分子的核心结构单元含有两条重链和两个轻链,所以每种抗体分子具有至少两个抗原结合位点。
C区Ig域距离抗原结合位点较远,不参与抗原识别。重链C区与免疫系统的其他效应分子和细胞相互作用,因此介导了抗体的大部分生物功能。
另外,重链以两种形式存在于它们的羧基末端的两端:B淋巴细胞等质膜中的重链锚膜结合抗体的一种形式,并且仅在分泌的抗体中发现其他形式。轻链的C区域不参与效应功能,并且不直接连接到细胞膜。
二硫键
重链和轻链以共价键连接二硫键形成于轻链羧基端半胱氨酸残基与重链CH1结构域之间。VL和VH结构域之间以及CL和CH1结构域之间的非共价相互作用也可能有助于重链和轻链的结合。每个抗体分子的两条重链由二硫键共价连接。
在IgG抗体中,这些键在CH2结构域的半胱氨酸残基之间形成,靠近被称为铰链的区域。在其他同型中,二硫键可能在不同的位置。非共价相互作用(例如第三个CH结构域[CH3])也可能导致重链配对。
变异度高的地区
不同抗体之间的序列差异和变异性大多局限于重链V区三段短链和轻链V区三段短链。这些最具多样性的部分被称为变异度高的地区.
Complementaritydetermining区域(CDRs)
可以认为,从每个可变域突出的手指类似于来自重链的三个手指
轻链上的三根手指聚集在一起形成抗原结合位点。由于这些序列形成了一个与结合抗原的三维形状互补的表面,高变区也被称为高变区互动性地区(CDRs)。
铰链区
抗体分子是灵活的,允许它们与不同的抗原阵列结合。每个抗体都包含至少两个抗原结合位点,每个位点由一对VH和VL结构域组成。许多Ig分子可以定位这些结合位点,使两个抗原分子在一个
平面(如细胞)表面可以同时啮合。这种灵活性在很大程度上是由铰链区在某些同型中位于CH1和CH2之间。在不同的同型中,铰链区长度从10个到60多个氨基酸残基不等。
Fab区域和Fc区域
铰链区特别易于通过酶蛋白水解裂解木瓜蛋白酶.木瓜蛋白酶裂解将抗体分子分解成两个相同的片段,保留原抗体的抗原结合特异性(Fab区域)和分子的剩余区域,后者由非抗原结合部分组成。后一个区域,对所有给定类别的抗体都是相同的,容易结晶,因此被称为Fc地区(可结晶的片段)。每个Fab区域和抗体的Fc区域在对抗原的抗体反应期间介导其本身的功能。Fab区与抗原结合,抗原偶联抗体的Fc区与吞噬细胞或细胞溶解细胞上的Fc受体结合,或者对免疫效应分子结合。通过这种方式,抗体用作生理学
连接病原体上存在的抗原和最终摧毁病原体的细胞或分子的桥梁。存在一个Fc受体家族;每个Fc受体在不同的细胞阵列上表达,并与不同种类的抗体结合。
免疫球蛋白类(类型)
研究人员利用针对免疫球蛋白恒定区的抗体和浆细胞瘤肿瘤细胞中提取的免疫球蛋白的氨基酸测序,发现重链恒定区序列可分为五种基本模式。这五个基本序列用希腊字母μ命名(μ),(delta), γ (gamma), ε(epsilon)和α(alpha)。每个不同的重链恒定区域称为同种型,给定抗体分子的重链的同种型决定了其类。
因此,带有μ同型重链的抗体属于IgM类;那些有重链为IgD;γ, IgG;ε组为IgE;和那些有α, IgA的人。重链的常数区长度为330个氨基酸残基(对于γ,和α链)或440个氨基酸(对于μ和ε链)。相应地,重链的分子量根据它们的类别而有所不同。IgA、IgD和IgG重链重约55 kDa,而IgM和IgE抗体重约20%。
IG类的物理特性
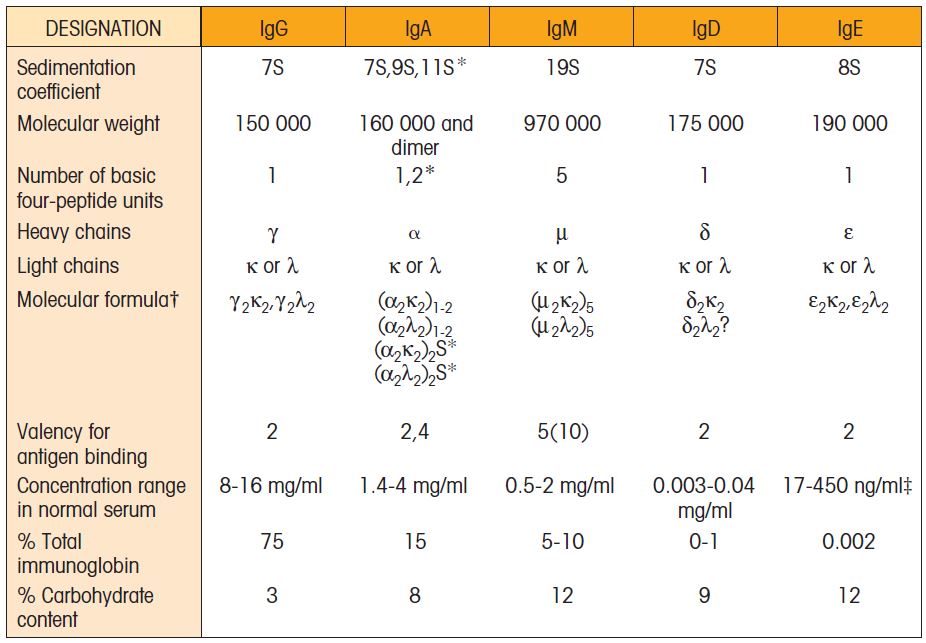
主要IG的生物学特性
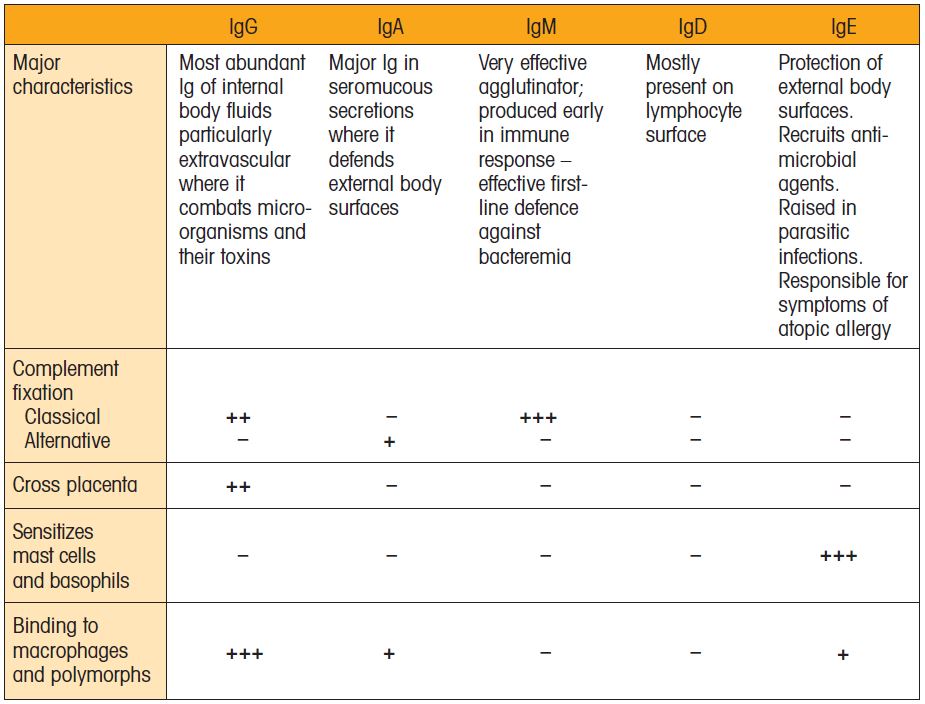
五种主要抗体的结构
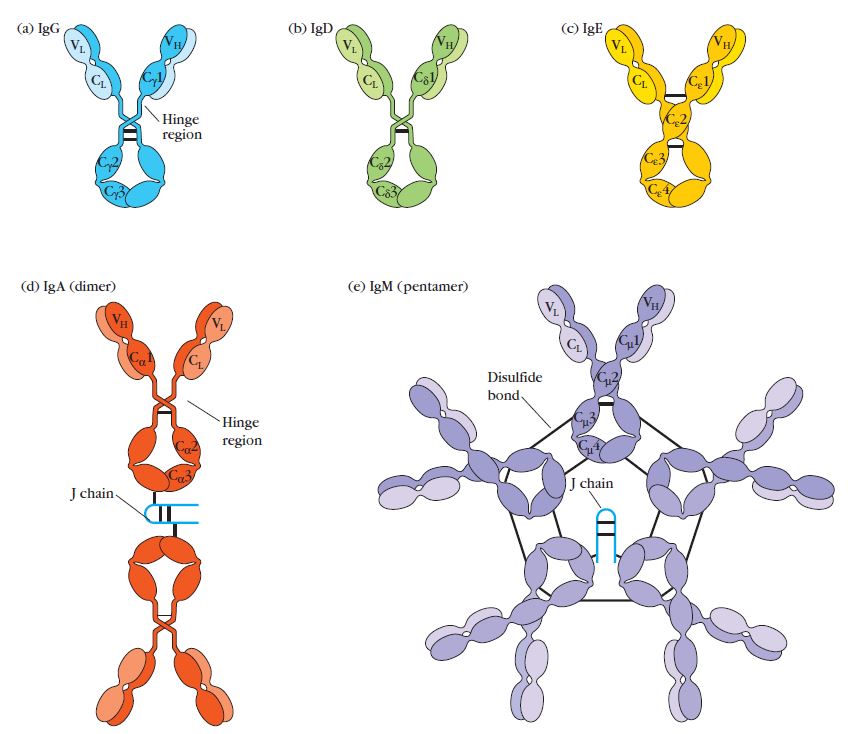
数字:五种主要抗体的一般结构。图像来源:库比免疫学第7版。


你好,我想用你的照片做我的博士论文,可以得到许可吗?
非常感谢你,我期待着您的回音
结构良好。介绍完整。做得好。保持下去。恭喜!