表的内容
- 线粒体是控制细胞生命和死亡的中间体细胞器。它们参与关键的代谢反应,合成大部分ATP并调节许多信号级联,包括细胞凋亡。
- 研究从不同的组织和培养细胞中分离出的功能性线粒体,有助于全面了解线粒体的功能。
- 线粒体可以从各种细胞或组织中分离出来。
植物(马铃薯块茎)线粒体的分离
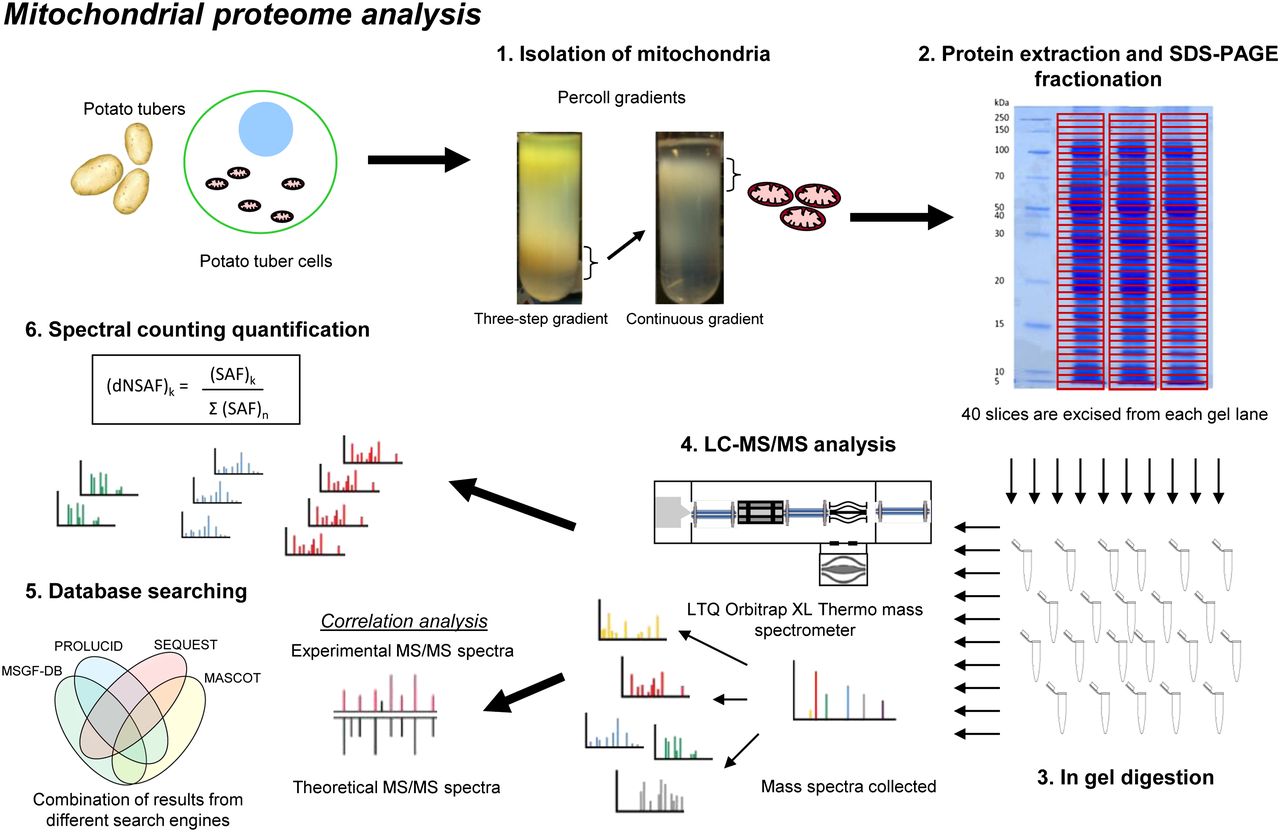
材料和试剂
- 曼尼尔
- 3-morpholinopropane-1-sulfonic酸(拖把)
- 氢氧化钾(KOH)
- 牛血清白蛋白
- 乙二胺四乙酸(EDTA)
- 半胱氨酸
- Percoll
- 蔗糖
- 二甲亚砜(DMSO)
- 液态氮
- 萃取介质
- 清洗缓冲
- 梯度缓冲区
- Percoll梯度
设备
- 马铃薯块茎
- 6 x 250 ml预冷角转子
- 8 x 50毫升预冷角转子
- 榨汁机
- 离心机(适用于50和250毫升试管)
- 油漆刷(软)
过程
- Pre-cool离心机转子。
- 在提取缓冲液中加入半胱氨酸和牛血清白蛋白,调至pH 7.3。半胱氨酸是一种抗氧化剂,BSA结合脂肪酸和酚类物质,可以干扰线粒体功能,BSA还作为蛋白酶底物,帮助保护线粒体蛋白免受损害。
- 将土豆削皮,用榨汁机将去皮的土豆榨汁(1公斤榨汁大约500毫升),然后将榨汁直接倒入1/2体积的榨汁介质中(这里是250毫升)。之后立即使用2m KOH调整pH为7.2,或者,对于更大的准备,在每公斤均质后。
- 将匀浆(总体积约750毫升)静置5分钟,让淀粉沉淀。
- 用漏斗过滤两层棉花(或类似的),然后转移到离心管。
- 将~ 190ml滤液转移到四个250ml离心管中。平衡管,并在3000 x g离心5分钟在一个6 x 250 ml预冷角转子。
- 小心地将上清倒入新鲜的离心管中(避免转移颗粒),平衡并在18000 x g离心10分钟。
- 轻轻丢弃上清液而不干扰粒料,并使用涂料刷将每个颗粒重悬于1ml 1x甘露醇梯度缓冲液中。重悬的颗粒总量8-10ml。
- 使用塑料巴斯德吸管准备两个Percoll阶梯梯度。避免混合的带子,首先轻轻地分层50%,然后28%,最后20% Percoll(所有在甘露醇)在50毫升离心管彼此之上。
- 在两个Percoll阶梯梯度上轻轻分层粗馏分(每个梯度最大4-5 ml)。
- 平衡管和离心机在40000 x g使用一个8 x 50 ml预冷角转子30分钟。
- 使用巴斯特移液管将线粒体带从每个管中转移到新的50ml管中,用洗涤缓冲液填充至多40ml并混合。
- 将两管相互平衡,18000 x g离心10分钟。
- 小心去除上清液,用洗涤缓冲液重悬了非常松散的颗粒,用洗涤缓冲液填充40毫升并混合。
- 在18000 x g的压力下平衡并离心10分钟。
- 去除上清液,用油漆刷将非常松散的颗粒重新悬浮在1ml 1x甘露醇缓冲液中,轻轻地覆盖在两个28% Percoll蔗糖梯度上。
- 平衡和离心机在40000 x g使用8 x 50毫升转子30分钟。
- 将线粒体带转移到两个新鲜的50ml离心管中,加入40ml洗涤液并混合。
- 以18,000 x g离心10分钟。
- 小心地去除颗粒的上清液并重复洗涤(作为步骤13-14)。
- 去除上清液,将每个颗粒重悬于500µl洗涤液中。添加5% (v/v) DMSO用于完整细胞器的冷冻。
- 在液氮中捕获冻结并储存100-200μL的等分试样。通过这种方式,如果在使用前很快迅速解冻,线粒体将保持其闭力和呼吸功能。
预期结果
每个颗粒的最终体积约为800µl,含有4-6 mg(总8-12 mg)线粒体蛋白。
微生物(酵母细胞)线粒体的分离
所需的材料
- 酵母文化
- 冷冻离心机
- 15毫升离心管
- 氯化钠(0.9%)
- 微量吸液管
- 冰冷裂解缓冲液
- 瓶
- 线粒体存储缓冲区
- 冰箱
- 15毫升微型离心管
过程
- 无菌转移过夜酵母培养物到两根15ml离心管中。
- 在4°C下将其达到500克10分钟。
- 小心地除去上清液而不会扰乱颗粒。
- 用微管用1ml氯化钠(0.9%)仔细冲洗颗粒。
- 使用微肺料丢弃来自离心管的氯化钠。
- 将颗粒重悬于1ml冰冷的裂解缓冲液中并使用微肺衬电池混合井。
- 在摇床上4°C孵育10分钟。
- 1000g, 4℃离心10分钟,小心取出上清。
- 将细胞颗粒重悬在1.5 ml冰冷破坏缓冲液中,用钝头针完全破坏细胞。
- 1000g的裂解液在4℃下离心10分钟。
- 将上清转移到一个15mL的新鲜试管中,并混合从步骤7中获得的上清。
- 6000g 4℃离心10分钟,弃上清。
- 用线粒体储存缓冲液洗涤颗粒。
- 6000g 4°C离心20分钟。
- 在线粒体储存缓冲液中重新悬挂颗粒,并在-20°C下储存。
从肝组织中分离线粒体(小鼠)
材料和试剂
- 常规均化器和杵(A和B)
- 小剪刀
- 镊子
- 离心管
- 老鼠
- 盐钾
- 钠盐
- 蔗糖
- 牛血清白蛋白
- 乙二胺四乙酸二水二钠(EDTA)
- 乙二醇 - 双(2-氨基乙醚)-N,N,N',N'-四乙酸(EGTA)
- 二硫苏糖醇(DTT)
- HEPES.
- 蛋白酶抑制剂(100倍)
- D-甘露醇
- 氯化镁六水合物(MgCl2)
- 氢氧化钾(KOH)
- 氢氧化钠(NaOH)
- 提取缓冲器
过程
- 通过颈椎脱位牺牲鼠标,立即取出肝脏并将其放入冰冷的烧杯中,用萃取缓冲液。
- 通过添加和除去冷新鲜提取缓冲液冲洗肝脏,直至大部分血液被移除(5-6次洗涤)。
- 将肝脏放入烧杯中,用小剪刀切成均匀状。
- 将切碎的肝脏转移到Dounce均质器中,加入大约3毫升冷提取缓冲液。
- 随着均化器放入冰容器中,用杵(松动器)轻轻地将组织磨损10次,另一个杵(更紧密)。避免形成气泡至关重要,以获得高质量的线粒体。
- 将匀浆转移到离心管中,用新鲜的冷提取缓冲液完成30-40毫升。遵循微分离心步骤。
- 将10分钟以700 xg和4°C离心10分钟。将上清液倒入新的冰冷管,并丢弃含有核和完整细胞的颗粒。
- 在4℃下再次以700×g再次离心操作,然后在4℃下再次离心10分钟并随后将上清液倒入新的冰冷管中。
- 10000 x g离心15分钟,4°C。弃掉上清液,将颗粒重新悬浮在冰冷的提取缓冲液中。
- 在4°C下,10,000 x g离心15分钟,丢弃上清,在最小体积(约0.3 ml)的提取缓冲液或特定的实验缓冲液中重新悬浮最终的颗粒。
- 分离后,用标准方法测定蛋白浓度。
预期结果
通常,从一个肝脏获得约30-40mg线粒体蛋白质。
从骨骼肌中分离线粒体(鼠标)
试剂
- 肌线粒体分离缓冲液1 (IBm1):将6.7 ml 1 M蔗糖、5 ml 1 M Tris/HCl、5 ml 1 M KCl、1 ml 1 M EDTA和2 ml 10% BSA混合,制备100 ml IBm1。调整pH值至7.4。加入蒸馏水至100毫升。
- 缓冲2用于肌肉线粒体分离(IBM2):将25ml 1 M蔗糖,3ml 0.1 M EGTA/Tris和1ml 1 M Tris/HCl混合,制备100ml IBm12。调整pH值至7.4。加入蒸馏水至100毫升。
过程
- 通过颈椎脱位杀死小鼠。使用手术刀,迅速取出感兴趣的骨骼肌,并将其浸泡在一个小烧杯中,该烧杯含有5毫升冰水磷酸盐缓冲盐水(PBS),并添加了10 mM EDTA。
- 用剪刀将肌肉切成小块,修剪可见的脂肪、韧带和结缔组织。
- 用补充有10mM EDTA的冰冷的PBS洗涤切碎的肌肉两次或三次。
- 将5毫升冰冷PBS中的碎肌重悬于补充有10mM EDTA和0.05%胰蛋白酶30分钟的5ml冰冷的PBS中。
- 200g离心5分钟,弃上清。
- 重新悬浮在IBM1中的颗粒。
- 使用特氟隆研磨棒以每小时1600转的速度均匀化肌肉;抚摸剁碎的肌肉十次。
- 将匀浆转移到50ml聚丙烯Falcon管中,并在4°C下700g离心10分钟。
- 将上清转移到玻璃离心管中,8 000g, 4℃离心10分钟。
- 丢弃上清液并将颗粒重悬于5ml冰冷的IBM2中。
- 8000 g 4°C离心10分钟。
- 倒出上清,重悬含线粒体的颗粒。你可以用玻璃棒来松开小球糊。避免加入IB,并尝试在丢弃上清后残留的少量缓冲液中重新悬浮线粒体。使用200ml移液器,避免在再悬浮过程中产生气泡。
- 将线粒体悬浮液转移到14毫升管中并将其保持在冰上。
- 使用伯脲方法测量线粒体浓度。
细胞培养中线粒体的分离
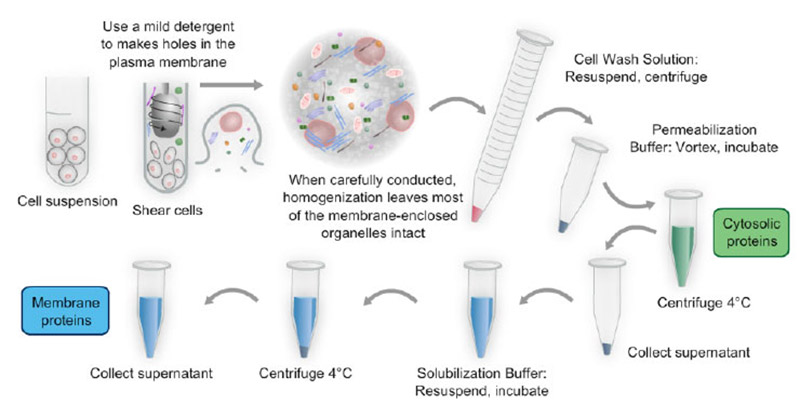
所需试剂
- 1升冷SE与以下成分:
- 250 mm蔗糖= 85.58g / l
- 5 mM Tris = 0.606 g/l
- 2 mM EGTA = 0.76 g/l
- 使用4˚C毫克水,pH至7.4使用2米HCl,保持冰
过程
- 将细胞生长至3×500cm2组织培养板中的85-95%汇合
- 关于生长,从所有媒体上吹走。
- 用30毫升冷STE洗涤细胞单层,吹掉所有练标
- 用30毫升冷STE和吸气洗涤第二次
- 使用清洁的剃刀刀片从板表面刮下细胞单层
- 在5ml冷STE中重新悬浮刮片细胞,转移到离心管(50ml)。重复两次。
- 对所有组织培养板重复步骤2-6,将细胞汇集到离心管中(每个托盘1管)。
- 在4℃2000rpm下旋转细胞10分钟。
- 小心地吸出上清液(颗粒稍微漫射)并保留细胞沉淀。
- 将细胞微球重悬在3.5 ml冷STE中,其中含有蛋白酶抑制剂和0.5%无脂肪酸BSA,转移到7ml冷玻璃-特氟隆均质器中。用1.5 ml含0.5%无脂肪酸牛血清白蛋白的STE清洗试管并转移到匀浆器中。
- 10次缓慢通过“紧密”柱塞均质细胞和转移匀浆到一个50毫升离心管。如有需要,可加冰STE。
- 在4˚C(1管)以3000rpm旋转3000rpm的匀浆3分钟
- 将上清液通过双层湿棉布过滤,并在4˚C下以10000 rpm旋转11分钟(2管)
- 倒出上清液并擦拭管内壁。
- 将线粒体颗粒重新悬浮在冰冷的STE中,并转移到15ml离心管中。加满冰STE,以11,600 G旋转10分钟。
- 用冷试管作为杵将线粒体颗粒重新悬浮在残留的上清液中。
- 保持线粒体在冰上。
预期结果
预期收益率从3 x 500厘米2在400-600μl中,85%的细胞汇集板是约15-25mg线粒体蛋白质。
参考
- https://bio-protocol.org/e1809.
- Frezza,C.,Cipolat,S.和Scorrano,L.(2007)。细胞器分离:来自小鼠肝,肌肉和培养的成纤维细胞的功能性线粒体。NAT PROTOC 2(2):287-295。
- Amigo,I.,Traba,J.和Rueda,C. B.(2016)。通过差动离心分离肝线粒体。生物协议6(10):E1809。
- Rueda, C. B., Traba, J., Amigo, I., Llorente-Folch, I., Gonzalez-Sanchez, P., Pardo, B., Esteban, J. A., del Arco, A.和Satrustegui, J.(2015)。线粒体ATP- mg /Pi载体SCaMC-3/Slc25a23可抵消由兴奋毒性损伤引起的parp -1依赖性线粒体ATP下降。J神经科学35(8):3566-3581。
- https://www.researchgate.net/profile/Irina_Perevoshchikova/post/How_can_I_isolate_mitochondria_from_cells/attachment/59d6280ec49f478072e9b900/AS%3A272429455216661%401441963651869/download/B2+mito+isolation+2+%281%29.docx
- https://www.nature.com/articles/nprot.2006.478
- https://idp.nature.com/authorize?response_type=cookie& client_id=grover&redirect_uri=https%3a%2f%2fwww.nature.com%2farticles%2fnprot.2006.478
- http://vlab.amrita.edu/?sub=3&brch=187&sim=327&cnt=2
- https://bio-protocol.org/e1226.

