表的内容
主要组织相容性I类(MHC I类)
- 这是第一节课MHC分子它编码在几乎所有有核细胞表面表达的糖蛋白。
- 它们的主要功能是通过胞质途径将抗原处理的多肽提交给t细胞毒性细胞。
- 在人类中,MHC I类蛋白由HLA-A、-B和-C基因编码。
- 这类MHC I类由两条链组成,即分子量为45000的跨膜糖蛋白,它与分子量为12000的非MHC编码多肽β2-微球蛋白非共价结合。
- 除了视网膜和大脑的细胞外,几乎所有体内的有核细胞都有I类分子。
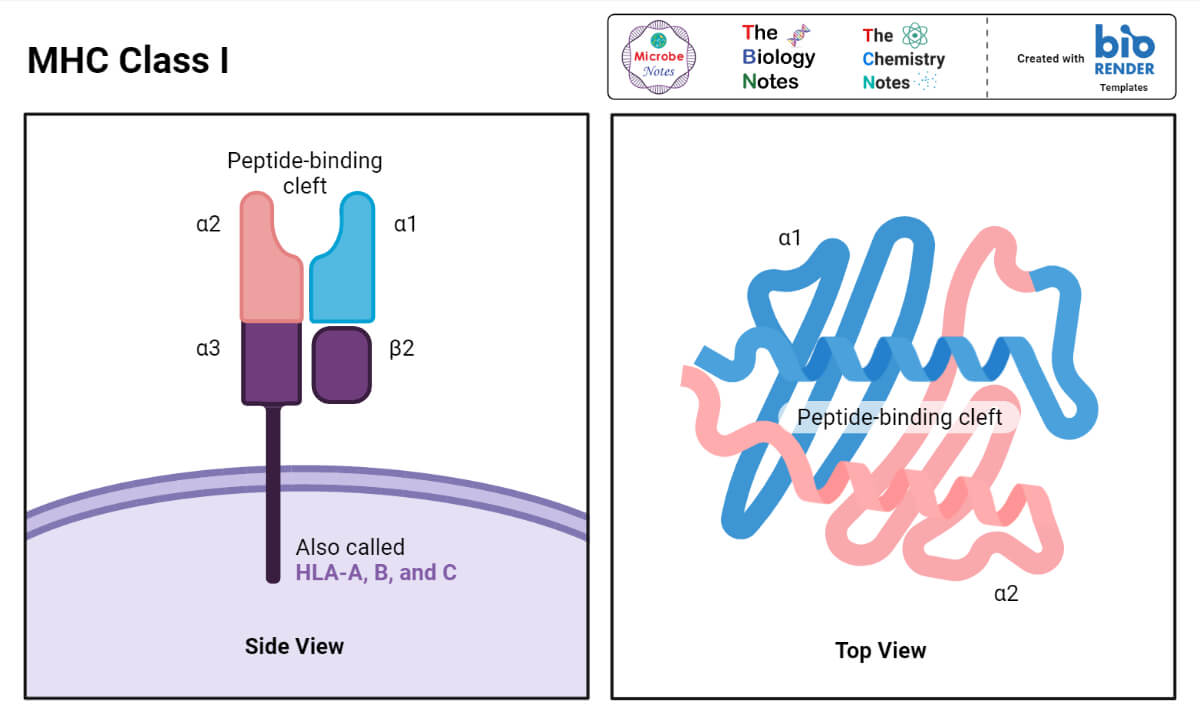
MHC的结构I类
- 人类和老鼠体内的MHC I类分子都由两个大小截然不同的多肽链组成。
- 较大的(α)链在人类中分子量为44 kDa,在小鼠中分子量为47 kDa,由MHC I类基因编码。
- 更小的链被称为β-2微球蛋白,在两种物种中分子量都为12 kDa,由一个非多态基因编码,该基因被定位在MHC复合体外。
- 人类MHC I类抗原a链由HLA-A位点编码与由HLA-B或HLA-C位点编码的结构没有已知差异,小鼠MHC I类抗原a链由H-2K位点编码与由H-2D或H-2L位点编码的结构也没有已知差异。
无论哪个位点编码α链,都可以细分为以下区域或区域:
- peptide-binding域;
- immunoglobulin-like域;
- 跨膜域;而且
- 胞质域。
- 肽结合域的n端最多;它是分子中唯一可以定位氨基酸序列中等位基因差异的区域。
- 从它的名字可以看出,分子的肽结合区域包括抗原肽结合的部位。
- 确切知道这个位点的等位基因差异是很有意义的,因为不同的MHC等位基因能更好或更坏地适应多肽,从而影响t细胞反应的大小。
- x射线晶体学显示,MHC I类分子中的肽结合位点看起来像一个裂缝,有一个“地板”和两个“墙”,由alpha链的螺旋状部分构成,称为alpha 1和alpha 2。
- 由于容纳肽的裂口的“底部”是关闭的,只有相对较小的肽,由9到11个氨基酸残基组成,可以被“塞”在那里。
- 免疫球蛋白样结构域结构保守,与抗体c区结构域相似。
- 它包含t细胞附属分子CD8的结合位点。
- 跨膜和细胞质结构域确保α链跨越细胞膜并被细胞正确表达。
- β-2-微球蛋白链对α链的正确表达也至关重要。
- 由于β-2-微球蛋白基因的缺陷,有一些突变的淋巴样细胞系(尤其是Daudi)不表达MHC I类分子。
主要组织相容性II类(MHC II类)
- II类MHC基因编码主要在抗原呈递细胞(巨噬细胞、树突状细胞和B细胞)上表达的糖蛋白,在那里它们向TH细胞呈递处理过的抗原肽。
- II类蛋白质由HLA-D区域编码,HLA-D区域有三个家族,DP-, DQ-和dr -编码分子。
- 这类基因保留了对免疫反应的控制,这些基因的不同等位基因形式赋予了对特定抗原产生免疫反应能力的差异。
- HLA-D位点编码蛋白由两个非共价缔合跨膜糖蛋白组成,分子量分别为33,000和29,000。
- 它们的组织分布有限,主要存在于巨噬细胞、树突状细胞、b细胞和其他抗原提呈细胞上。它们也在IFN-γ诱导的其他细胞如内皮细胞和/或上皮细胞上表达。
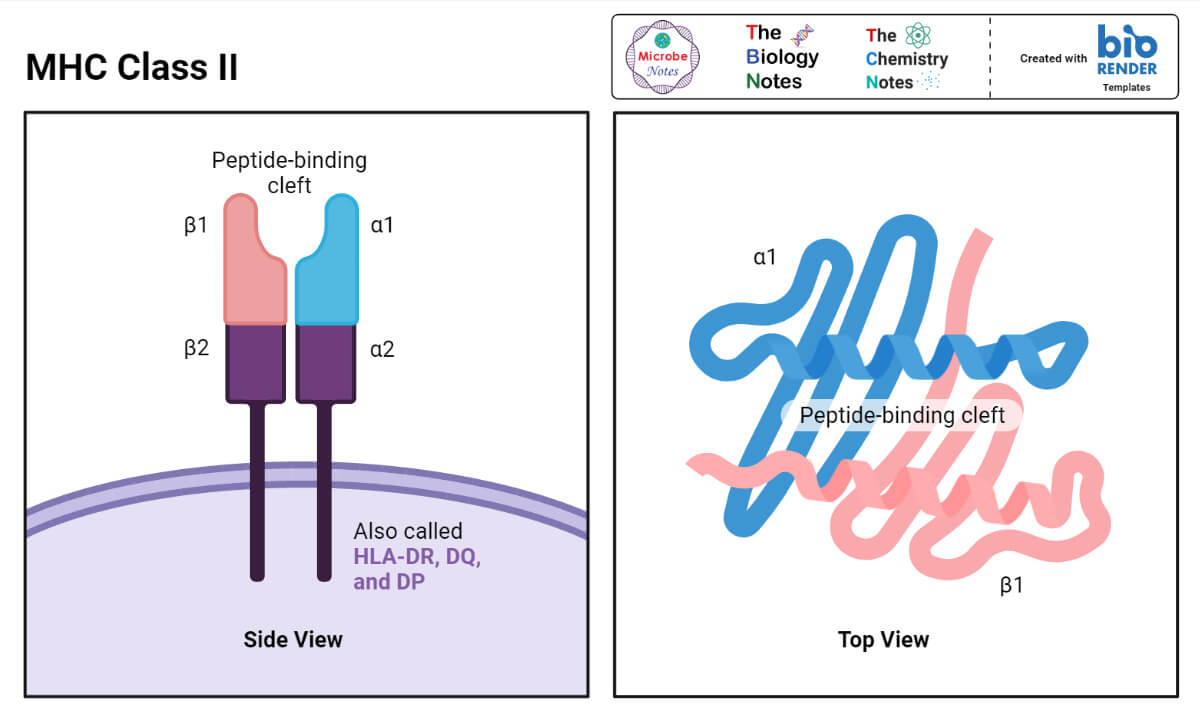
MHC II类结构
- 人类和小鼠体内的II类MHC分子都由两个多肽链组成,它们的大小虽然不完全相同,但却相似。
- 其中一个叫α,另一个叫β。
- α链的分子量为32 ~ 34kda, β链的分子量为29 ~ 32kda。
- 每条链都由一个单独的基因控制。
- 由此可见,小鼠I-A位点实际上由i - α和i - β基因组成,人类HLA-DR位点由HLA-DRα和HLA-DRβ等组成。α和β基因均具有多态性。
- 一些MHC II类位点的β基因可以串联复制,因此,一个细胞可以有两个或三个基因,而不是每个同源染色体有一个基因。
- 正因为如此,一个细胞可以同时表达每个MHC II类位点的两个以上的等位基因产物。
- 例如,一个细胞可以表达其HLA-DR分子的等位产物,可以被识别为HLADRα1 - HLA-DRβ1;HLA-DRα2 - HLA-DRβ2;HLA-DRα1 - HLA-DRβ2;HLA-DRα2 - HLA-DRβ1;等。
- 总的来说,由于这种串联复制现象,一个细胞可以同时表达多达20种不同的MHC II类基因产物。
MHC II类分子的α链和β链的结构类似于MHC I类分子的α链,前者也可分为肽结合结构、免疫球蛋白样结构、跨膜结构和细胞质结构域。
然而,一个重要的区别是,II类分子中的肽结合裂口是由α链和β链形成的。
尽管在空间上彼此位置很近,形成裂缝的α链和β链的螺旋并没有物理上的结合在一起。
正因为如此,II类MHC分子中容纳肽的裂缝的“底部”是“打开的”,或者说“有一个洞”。
这使得MHC II类分子能够容纳比MHC I类分子更大的肽。
MHC II类分子的免疫球蛋白样结构域包含t细胞辅助分子CD4的结合位点。
该位点不能结合上述CD8分子。
主要组织相容性III类(MHC III类)
- III类MHC基因编码各种具有免疫功能的分泌蛋白,包括补体系统的组成部分和参与炎症的分子,如细胞因子。
抗原处理和呈递
- t淋巴细胞对蛋白质抗原的识别需要抗原提呈细胞对抗原进行处理,然后在细胞膜上的MHC分子裂口内显示。
- 这涉及到将蛋白质抗原降解为多肽,这个过程被称为抗原处理。
- 当抗原被加工并降解为多肽时,它就会与细胞质内的MHC分子结合,形成多肽-MHC复合物。然后这个复合物被运送到细胞膜上,在那里通过抗原呈递的过程显示出来。
- MHC I类和II类MHC分子与多肽相关,这些多肽在不同的细胞间隔中被加工过。
- I类MHC分子结合肽派生内源性抗原在细胞的细胞质内处理过的蛋白质,如肿瘤蛋白、细菌蛋白或病毒蛋白或细胞蛋白,并在cytosolic通路.
- II类MHC分子结合多肽派生外源性抗原被吞噬或内吞作用内化并在内吞作用的途径.
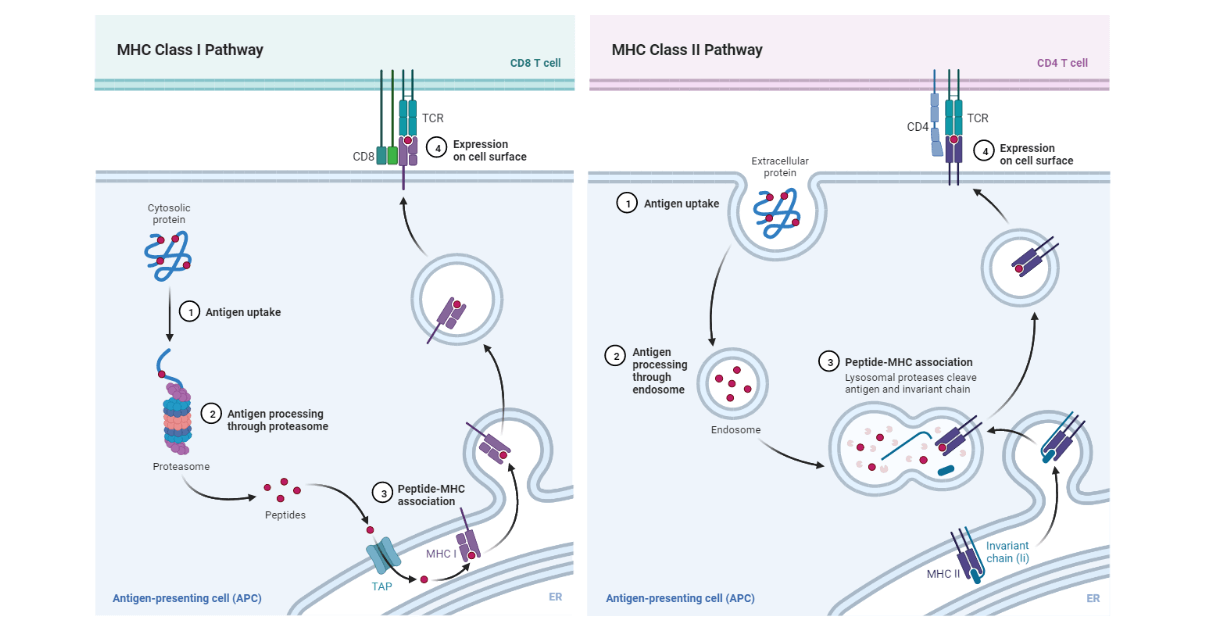
A.胞质途径:内源性抗原
- 这是利用I类MHC分子处理和呈递内源性抗原的途径。
- 抗原蛋白通过存在于所有细胞中的胞质蛋白水解系统在细胞内降解为短肽。这些用于蛋白质水解的蛋白质上附着着一种叫做泛素的小蛋白质。
- 泛素-蛋白质结合物然后被一种称为蛋白酶体的多功能蛋白酶复合体降解。
- 每个蛋白酶体是一个大的(26S)圆柱形粒子,由四个蛋白质亚基环和一个直径为10-50 Å的中心通道组成。
- 蛋白酶体可以在一个依赖atp的过程中分裂2-3种不同氨基酸组合之间的肽键。
- 泛素-蛋白质复合物的降解发生在蛋白酶体的中央中空处。
- 然后多肽从胞浆运输到粗面内质网。这是由指定的转运蛋白实现的TAP(与抗原处理相关的转运蛋白)是一种跨膜的异二聚体,由两种蛋白质组成:TAP1而且TAP2.
- TAP1和TAP2蛋白都有一个结构域投射到粗面内质网(RER)的管腔内,还有一个atp结合结构域延伸到细胞质中。
- TAP1和TAP2都属于atp结合盒蛋白家族,存在于包括细菌在内的许多细胞的细胞膜上。
- 它们介导依赖atp的氨基酸、糖、离子和多肽的转运。
- 由蛋白酶体在细胞质中产生的多肽,通过利用水解ATP的过程被TAP蛋白转移到粗面内质网(RER)。TAP蛋白对8-10个氨基酸的肽段具有高亲和力,这是I类MHC结合的最佳长度。
- 此外,TAP蛋白更倾向于疏水或碱性羧基端氨基酸的肽段,这是I类MHC分子首选的锚定残基,因此TAP被优化为运输肽段,将与I类MHC分子相互作用。
- 接下来,与I类MHC组装的多肽在促进多肽折叠的伴侣分子的辅助下进行。
- I类MHC分子的α和β -2微球蛋白组分是在沿粗面内质网的多聚体上合成的。这些组分被组装成一个稳定的I类MHC分子复合体,该复合体可以离开RER,需要该类分子结合槽中的肽的存在。
- 第一个参与的伴侣被称为calnexin,它是内质网的常驻膜蛋白。Calnexin与I类α链结合并促进其折叠。当β -2微球蛋白与α链结合时,钙蛋白被释放,I类分子与伴侣钙蛋白和tapasin结合。
- Tapasin是一种TAP相关蛋白,它使TAP转运蛋白靠近I类分子,并使其获得抗原肽。α链-2-微球蛋白异二聚体与TAP蛋白的物理结合促进了肽在暴露于RER之前被I类分子捕获。
- 未被I类分子结合的多肽迅速降解。
- 结合后,I类分子表现出更高的稳定性,并能与钙网蛋白和tapasin分离,离开内质网,通过高尔基体进入细胞表面。
- 另一种伴侣蛋白ERp57与钙连接蛋白和钙网蛋白复合体有关。这一内质网蛋白在I类肽组装和装载过程中的确切作用尚未被确定,但它被认为有助于I类链成熟过程中二硫键的形成。
B.内吞途径:外源性抗原
抗原提呈细胞可以通过吞噬、内吞或两者兼有的方式将抗原内化。巨噬细胞通过吞噬和内吞两种方式将抗原内化。大多数其他APCs的吞噬能力较差,只能通过胞吞作用或内吞作用将抗原内化,而大多数其他APCs不具有吞噬作用,因此它们只能通过胞吞作用或胞吞作用将外源性抗原内化。b细胞也是apc,通过受体介导的内吞作用,利用抗原特异性的膜抗体受体有效地将抗原内化。
- 当外源性抗原被内化时,它在内吞处理通路的隔室中被降解为多肽。
- 抗原分解成多肽需要1-3小时才能横过内吞途径,并以肽类II型MHC复合体的形式出现在细胞表面。
- 在这一途径中,有三个酸性区室:早期核内体(pH 6.0-6.5),晚期核内体或内溶酶体(pH 5.0-6.0);溶酶体(pH 4.5-5.0)。内化的抗原从早期的核内体移动到晚期的核内体,随后移动到溶酶体,在那里它们遇到水解酶,每个腔室的pH值都在下降。
- 溶酶体具有独特的40种酸依赖性水解酶集合,包括蛋白酶、核酸酶、糖苷酶、脂肪酶、磷脂酶和磷酸酶。在内吞途径的间隔内,抗原被降解为由13-18个残基组成的寡肽,与II类MHC分子结合。水解酶在低Ph值条件下具有活性,可抑制抗原处理的化学试剂和蛋白酶抑制剂的Ph值升高。
- 多肽从一个腔室到另一个腔室的运动与小的运输囊泡有关。
- 到达最后的隔室后,它们返回细胞外围与质膜融合,使表面受体循环。
- 抗原提呈细胞同时表达MHCI和MHC II分子,因此,为了防止MHC II与I类MHC的同一组抗原肽结合,必须存在一些机制来防止这一点。
- 当MHC II在RER内合成后,三对II类链与一种被称为an的蛋白质的预组装三聚体相结合不变的链CD74 (Ii)。三聚体蛋白与II类MHC分子的肽结合裂口相互作用,阻止任何内源性肽与裂口结合,而II类MHC仍然在RER内。
- 不变链还参与了II类MHC及其链的折叠、从内质网的退出以及从跨高尔基网络进入内吞小泡的内吞处理途径。
- 其次,肽段通过取代CLIP (II类相关不变链肽)与II类MHC分子结合。大多数II类mhc不变链复合体从内质网运输,在那里通过高尔基复合体和反式高尔基网络形成,然后通过内吞途径,从早期核内体移动到晚期核内体,最后到达溶酶体。
- 这增加了从每个隔室到下一个隔室的蛋白质水解活性。
- 这导致不变链的逐渐降解,留下一个被称为CLIP (Class II-associated invariant chain peptide)的不变链短片段,在不变链被内体分隔室裂解后,它仍然与II类分子结合。
- CLIP占据了II类MHC分子的肽结合槽,防止了抗原肽的过早结合。HLA-DM分子催化CLIP与抗原肽的交换。它存在于哺乳动物细胞,老鼠和兔子中。HLA-DM是新古典和非多态的。
- 当HLA-DM和II类CLIP复合物反应时,它促进了CLIP与另一肽的交换,但当HLA-DO存在时,它可以与HLA-DM结合,降低了交换反应的效率。
- 与HLA-DM结构相似的HLA-DO参与调节HLA-DM的功能,但其功能不明确。
非肽抗原的呈现
- 非肽抗原也能被免疫系统识别,这些抗原来源于感染因子,如结核分枝杆菌。
- 这些抗原被t细胞受体识别δγtcr(t细胞受体是αβ和δγ的二聚体)来源于细菌病原体的糖脂,如结核分枝杆菌。
- 这些非蛋白抗原由非经典I类分子CD1家族的成员呈现。
- CD1分子家族与β2-microglobulin它的结构和MHC I分子相似。它有5个编码人类CD1分子的基因(CD1A-E,编码基因产物CD1a-d, E尚未被识别。这些基因位于染色体上,而不是在MHC I上。
- 根据序列同源性将它们分为两组。组1包括CD1A、B、C和E;CD1D在第2组。所有的哺乳动物都有CD1基因,尽管数量各不相同。啮齿动物只有第2组CD1基因,而兔子和人类一样,有5个基因,包括第1组和第2组。
- CD1与经典I类分子的序列同一性远远低于I类分子之间的序列同一性。CD1D1与I类MHC分子比较表明,CD1D1的抗原结合槽比I类MHC分子更深,体积更大。
抗原处理和呈递的临床意义
- 有时抗原递呈细胞(APCs)可以传递自身抗原,引起自身免疫性疾病。当自我抗原被提交给t细胞时,它会启动针对我们自身组织的免疫反应,导致自身免疫紊乱,如格雷夫斯病,类风湿性关节炎。
- 在格雷夫斯病中,TSHR(促甲状腺激素受体)作为自我抗原呈现给t细胞,激活b细胞,b细胞产生针对甲状腺中TSHR的自身抗体。这导致TSHRs的激活,导致甲状腺机能亢进和甲状腺肿大。
参考文献
- 免疫学,Kuby,第5版
- Prescott微生物学,第5版
- Lippincott的免疫学插图评论
- 《综合免疫学:抗原和免疫原》弗雷德里克C.麦克杜菲著
- 医学微生物学,Jawertz,第23版
- 《免疫生物学:健康与疾病中的免疫系统》第5版:第3章,b细胞和t细胞受体对抗原的识别
- http://resources.schoolscience.co.uk/unilever/16-18/proteins/Protch7pg1.html
- https://microbiologyonline.org/index.php/about-microbiology/microbes-and-the-human-body/antibody-antigen-complex
- https://www.sigmaaldrich.com/technical-documents/articles/biology/antigens-epitopes-antibodies.html
- https://www.technologynetworks.com/immunology/articles/antigen-vs-antibody-what-are-the-differences-293550
- https://en.wikipedia.org/wiki/Antigen
- https://www.britannica.com/science/antigen
- https://www.webmd.com/diabetes/qa/what-are-antigens
- https://bio.libretexts.org/Bookshelves/Microbiology/Book%3A_Microbiology_ (Kaiser) / Unit_6 % 3 3 a_antigens_and_epitopes a_adaptive_immunity / 3 a_introduction_to_adaptive_immunity 12% / 12.2%
- https://www.news-medical.net/life-sciences/The-Characteristics-of-Antigens.aspx
- https://www.biologyonline.com/dictionary/tolerogen
- https://www.toleranzia.com/technology/tolerogen-platform/
- https://en.wikipedia.org/wiki/Tumor_antigen
- https://www.prospecbio.com/viral_antigens
- https://www.creative-diagnostics.com/Viral-Antigens.htm
- https://www.msdmanuals.com/professional/hematology-and-oncology/tumor-immunology/tumor-antigens
- https://en.wikipedia.org/wiki/Cluster_of_differentiation
- https://www.sinobiological.com/research/cd-antigens/what-is-cluster-of-differentiation

