表的内容
几丁质是什么?
甲壳素是一种复杂的同聚糖,由氨基糖氨基葡萄糖组成,是自然界中含量第二丰富的多糖纤维素.
- 它在自然界中广泛分布,发现在细胞壁中真菌,节肢动物的外骨骼,以及其他某些结构无脊椎动物.
- 如纤维素,如纤维素一样,甲壳素,由于广泛的水解活性,不会在生物圈中积聚土壤微生物.
- 几丁质以共价或非共价与其他结构分子以及环境相结合。
- 甲壳素的脱乙酰化衍生物称为壳聚糖具有生物医学应用,因为它充当抗微生物和水合剂。用酶或化学水解催化甲壳素对壳聚糖的转化催化。
- chitin一词来源于希腊语“chiton”,意思是铠甲。
- 根据来源的不同,甲壳素有两种形式;α和β构象。还知道三分之一讨论较少的γ形式。
- 这些Allomorphs在微原纤维的方向上彼此不同。
- 甲壳素被认为是一种重要的聚合物结构,因为它具有高孔隙率、生物降解性、可预测的降解率和结构完整性等特点。
- 几丁质与纤维素相似,由于缺乏降解所需的酶系统,脊椎动物也无法消化它。
几丁质的结构
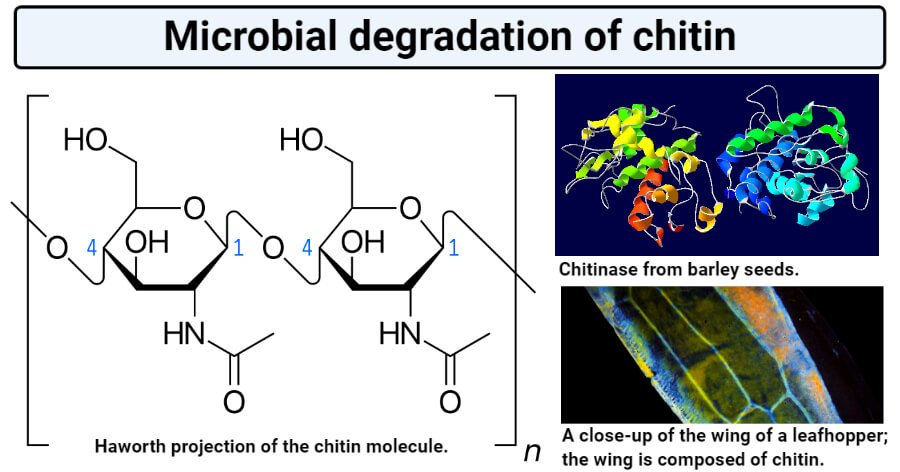
甲壳素是葡萄糖的n -乙酰氨基葡萄糖衍生物的β(1,4)连接均聚物,与纤维素结构相似。
- 在几丁质中,β- d -葡萄糖单元第二个碳原子的醇羟基被n -乙酰氨基取代。
- 甲壳素不溶于水和非极性溶剂,尽管存在电荷在乙酰基。
- 几丁质是由n -乙酰- d -葡萄糖胺单元通过β-1,4-葡萄糖键连接而成的线性聚合物。这种结构形成三维的α-螺旋结构。
- α-螺旋几丁质结构的稳定性是由n -乙酰侧链的氢键形成的。
- 然而,在自然界中,几丁质聚合物通过分子间氢键与细胞外结合,形成晶体微原纤维结构。
基于几丁质纤维的方向和聚合物内的键,甲壳素存在于三种不同的构象中。
1.α甲壳素
- 在α-甲壳素中,几丁酸纤维是反平行的,导致正晶素取向。
- 强氢键使甲壳质结构在a和b方向的构象稳定,而c方向的作用力较弱。
- 两种不同类型的氢键存在于α-几丁质中,以稳定晶体结构;板内和板间氢键。
- 在酰胺I和酰胺II的羰基之间发生intrasheet氢键。
- CH之间存在层间氢键2羟基侧链和羰基。
- 甲壳素晶体结构的分解温度取决于氢键,因此α-甲壳素的分解温度最高,为330℃。
2.β甲壳素
- 在β-甲壳蛋白中,几丁质纤维彼此平行,仅通过克拉索氢键合稳定。它由单斜视单元组成。
- β-几丁质晶体结构的分解温度在230℃时最低,因为它的氢键数最少。
3.γ-甲壳素
- γ-几丁质构象的特征是交错平行和反平行排列的几丁质纤维。
- γ-几丁质的氢键数和方向与α-几丁质的氢键数和方向相似。γ-几丁质中既有板间氢键,也有板内氢键。
- γ-几丁质晶体结构的分解温度为310℃。
几丁质酶是什么?
- 几丁质酶是一组糖基水解酶,大小从20kDa到90kDa不等,广泛存在于细菌、真菌、酵母、植物、放线菌和动物等生物体中。
- 几丁质酶将几丁质直接降解为更小的、低分子量的壳低聚物,用于工业、农业和医疗等领域。
- 几丁质酶通过降解存在于n -乙酰氨基葡萄糖单元之间的β-1,4键来减少聚合物的长度,最终导致单体单元的形成。
- 几丁质酶大致分为两类;exo-chitinases endo-chitinases。
- 几丁质内酯酶在内部任意位点分裂聚合物链,从而形成二十六烷基壳二糖的二聚体和水溶性低分子质量的葡萄糖胺多聚体,如壳三糖和壳四糖。
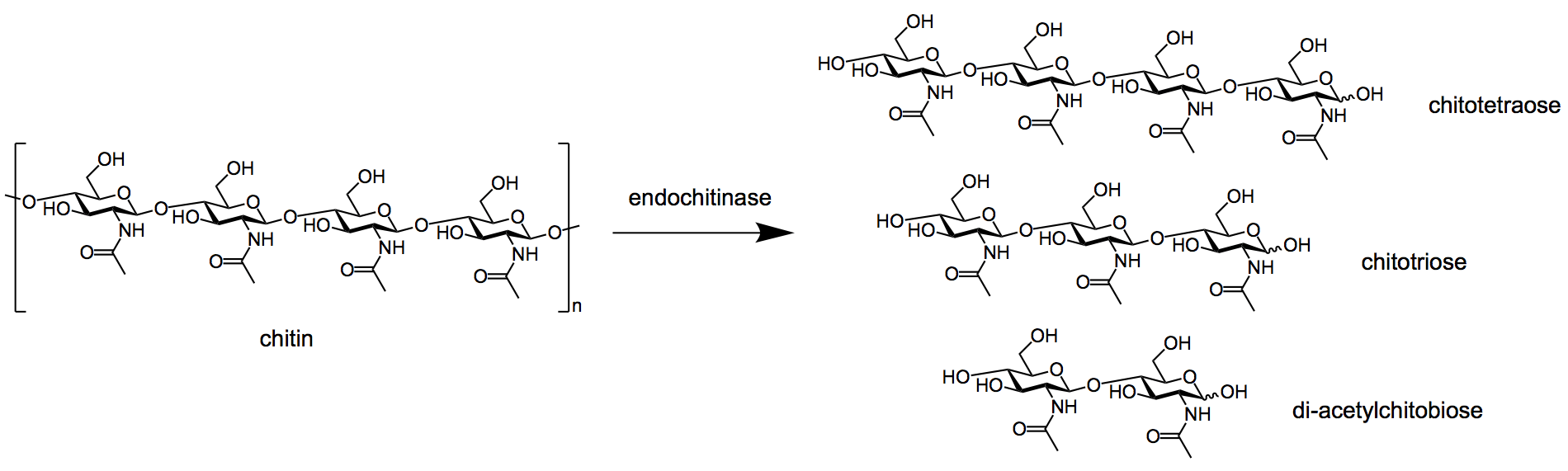
图:几丁质内酯酶将几丁质分解成多种产物。图像来源:维基百科.
- 外周质酶又进一步分为两组;chitobiosidases和1、4 -β-glucosaminidases。
- 壳生物糖苷酶催化随后的二乙酰壳二糖的释放,开始于几丁质纤维的非还原。
- 1,4-β-葡萄糖苷酶将几丁质内酯酶和壳生物糖苷酶的低聚产物裂解,生成氨基葡萄糖的单体产物。
- 根据不同生物的几丁质酶之间的氨基酸相似性,提出了5个不同的分类和3个家族(家族18、19和20)。
- 18族几丁质酶主要来源于病毒、真菌、细菌和一些植物。这些包含了一些保守的氨基酸重复序列和8股平行β层的酶核。
- 家族19是植物几丁质酶和Treptomyces家族18和19几丁质酶在氨基酸上没有相似之处,其三维结构也不同。
- 家族20含有来自细菌、真菌和人类的n -乙酰氨基葡萄糖酶。
- 几丁质酶由一组不同的酶组成,这些酶在分子结构、底物特异性和催化机制上都不同。
- 由于其工业应用,多年来微生物蛋白酶的生产增加了。
- 采用补料分批发酵、连续发酵和液体分批发酵等方法。
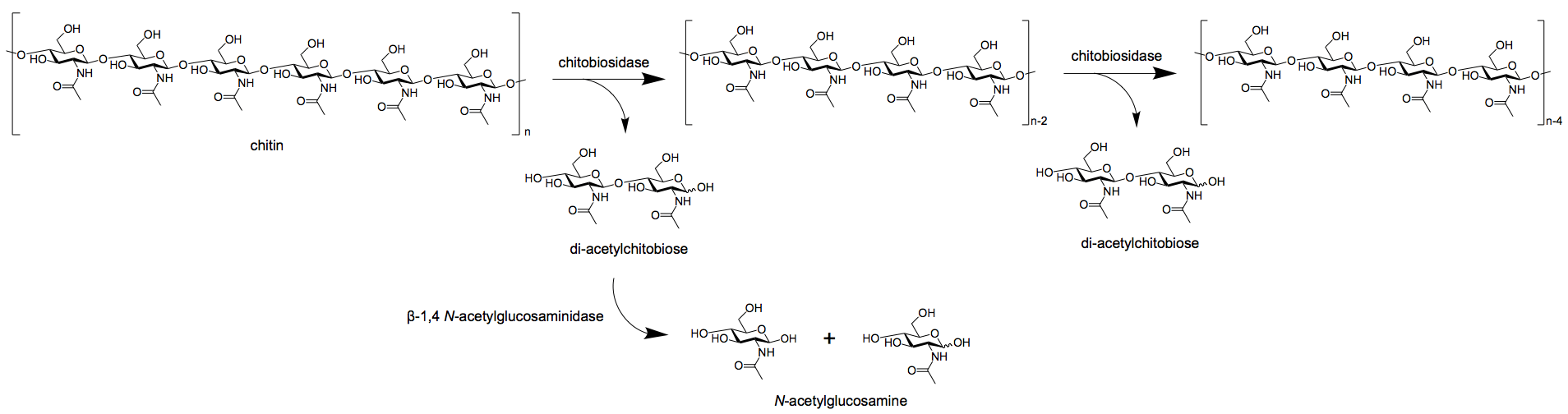
图:通过β-1,4 n-乙酰葡糖胺酶氨基氨基氨基氨基氨基氨基氨基氨基酯酶将exochitinase分解成二聚体和单体。图像来源:维基百科.
参与甲壳素降解的微生物
1.Chitinolytic细菌
- 几丁醇溶解细菌在不同的栖息地中广泛分布,几丁酶由许多Gram阴性和革兰氏阳性细菌产生,但不是由archaeackia。
- 几丁质分解菌属的弧菌和发光细菌都与浮游动物有关,以及在海洋中发现的与浮游动物和甲壳有关的颗粒物质。
- 细菌的种类弧菌,光细菌,气单胞菌,胞噬菌,链霉菌,光细菌,芽孢杆菌,梭菌,和色素细菌是众所周知的几丁质分解细菌。
- 这些是二乙酰壳二糖的专门利用者,而n-乙酰氨基葡萄糖的积累表明在甲壳素低聚物的随机水解过程中是不可利用的单体。
- 依甲溶解的细菌在新鲜水域中也丰富,特征属Serratia,Chromobacterium,假单胞菌,黄酮杆菌,芽孢杆菌,噬细胞菌属johnsonae.
2.Chitinolytic真菌
- 几丁质溶解真菌的主要栖息地是土壤,在土壤中,真菌的几丁质溶解活性甚至可能超过细菌。
- 参与几丁质分解的最常见的真菌种类包括毛霉类Mortierella.spp和deuteromycetes和ascomycetes喜欢aspergillus.那verticillium,thielavia,trichoderma,penicillium,和Humicola.
- 这些真菌的几丁质溶解系统是可诱导的,活性随着富含几丁质底物的增加而增加。
- 淡水物种Chrytriomyces和Karlingia专性几丁质,降解几丁质以满足其营养需求。
3.黏菌、原生动物和藻类
- 像黏菌(真正的黏菌)多头绒泡菌是产生细胞外几丁质酶复合物的溶酶的丰富来源。
- 土壤原生动物等Hartmanella和Schizopyrenus,还有黏菌疟原虫也已知能产生几丁质酶,参与消化被这些无脊椎动物吞噬的几丁质食物颗粒。
- 一种无色异养硅藻,Nitzchia阿尔巴是目前已知唯一能消化甲壳素的硅藻。
参与依赖酸的降解的酶
有不同的班级和几个花序酶,其作用于几丁质降解的不同阶段,甚至可能利用不同的降解机制。重要的几个花序酶包括家庭18,19和20个几丁酶。这些花序酶可能在它们的来源和结构部件中不同。
1.家庭18几丁质酶
- 家族18几丁质酶保留酶,包括几丁质酶和壳聚糖酶。
- 它们存在于许多生物体中,包括古生菌、细菌、真核生物和病毒。这类酶被广泛研究。
- 这些几丁质酶根据其氨基酸序列的相似性进一步分为A、B和C亚类。
- 在一些18家族的几丁质酶中,只发现一个催化结构域,而其他几丁质酶可能有一个或多个碳水化合物结合模块。
- 与典型的双保留机制相比,家族18几丁质酶的催化机制有一些修饰。
- 几丁质酶家族18不是使用酶的羧酸侧链作为催化亲核试剂,而是使用C-1糖的乙酰氨基。
2.家庭19几丁质酶
- 家庭,因为他们使用的转化机制,导致α-异头水解而不是保持机构19和几丁质酶是从家庭18和几丁质酶不同。
- 传统上,家族19几丁质酶已知只存在于植物中,但一些细菌几丁质酶多年来也加入到家族中。
- 几丁质酶家族19由催化结构域组成,该催化结构域具有溶菌酶样褶皱,具有浅底物结合槽,不富含芳香残基。
- 由于缺乏这些酶的结构信息,它们与底物相互作用的信息也很有限。
3.几丁质去乙酰酶抑制剂
- 甲壳素去乙酰酶包括肽聚糖n -乙酰氨基去乙酰酶和肽聚糖n -乙酰壁酸去乙酰酶,它们去除底物中的乙酰基。
- 这些酶是必不可少的,因为它们减少了结构中的分支,从而减少了其他外酶和内酶的空间位阻。
影响甲壳素降解的因素
几丁质在土壤或人工介质上的降解会受到以下几个因素的影响:
1.水分含量
- 甲壳素降解过程在游离水存在和完全饱和的情况下发生迅速。
- 然而,增加水量对降解过程的影响很小,直到曝气受到砍伐的影响。
2.添加葡萄糖
- 培养基或土壤中添加葡萄糖降低了几丁质降解的速率,因为生物倾向于利用容易获得的来源而不是几丁质。
- 葡萄糖是一种现成的能源,易于代谢。反过来,这导致延迟或降低的甲壳素降解。
- 然而,在没有这些来源的情况下,甲壳素降解会增强。
3.曝气
- 由于大多数依甲酸钠微生物是有氧性并且在高氧环境中茁壮成长,因此丁蛋白降解的速率也增加。
- 在一定浓度的CO2中也可以观察到一定程度的降解,因为它允许兼性好氧菌和厌氧菌参与。
- 纯氧环境在某些情况下可能是有毒的,特别是在有现成能源的情况下。
4.有机物质
- 富含甲壳素的有机物的存在也提高了甲壳素的降解速率。
- 有机物质的增加会增加底物浓度。当微生物利用更容易获得的能量形式时,脱脂的降解速率可能较慢,然后是几丁酸降解。
- 其他形式的纤维素和木质素等能量也应存在,因为它允许微生物生长以形成蛋白质和酶。
甲壳素降解过程(简单步骤)
甲壳素的水解过程分为两步;
1.解聚
- 解聚是通过n -乙酰氨基葡萄糖单元之间的β-1,4键的断裂来减少几丁质聚合物长度的过程。
- 该过程通过壳聚糖酶的几丁质酶的作用释放n -乙酰氨基葡萄糖。
- 初始酶促作用是几丁质酶,其是非编纂酶或exochitin酶,导致千核苷酸或千核苷酸的形成。
- 像壳生物酶一样的外酶进一步作用于壳生物酶形成单体单元。
- 在某些情况下,甲壳素可能转化为壳聚糖,这需要甲壳素酶的作用。
2.脱乙酰化
- 解聚之后是乙酰化,导致葡萄糖胺单元和醋酸的释放。
- 甲壳素脱乙酰酶作用于n -乙酰氨基葡萄糖二聚体或三聚体,导致大分子催化降解为小分子。
- 这一步的最终产物是葡萄糖胺和乙酸,然后微生物将其用于各种目的。
几丁质微生物降解机制
- 不同来源产生的大量甲壳素被基质的等量循环利用所平衡。
- 在自然界中,大多数甲壳素的降解是由微生物进行的,由另一组微生物进行。
- 甲壳素降解发生在不同的栖息地,如海洋、动物内脏和土壤。
- 微生物降解甲壳素的机制有两种;几丁质破碎机制和去乙酰化机制。
1.Chitinoclastic
- 甲壳素降解的几丁质断裂机制仅发生在糖苷键的水解。通过这种机制降解几丁质的生物称为几丁质降解生物。
- 在该机制中,由几丁质酶组成的基质由几丁质酶作用。
- 胞外质酶从多糖链的非还原端分解乙酰壳二糖单元。
- 几丁质酶裂解随机沿着链糖苷键,最终导致形成diacetylchitibiose的作为主要产物,其中一些三乙酰壳三糖一起。
- 这些酶的活动可能并不总是分布的,因为这些酶的作用取决于底物的性质。
- β- n -乙酰氨基葡萄糖酶水解壳二糖(结构上为二乙酰壳二糖)为n -乙酰氨基葡萄糖。
- 在一些情况下,β-N-乙酰葡糖胺酶也可以作为脱噬酶弱起作用,从聚合物链的非还原末端切割单糖单元。
- 在一起,几章酶和β-N-乙酰葡糖胺酶形成'依甲酰基溶解系统'。
2.脱乙酰化
- 脱乙酰化是甲壳素降解的一种替代机制,包括甲壳素转化为壳聚糖。
- 这种几丁质降解机制在淡水系统或土壤沉积物中是重要的。
- 参与去乙酰化机制的一组酶被称为去乙酰化酶。这些酶催化n -乙酰氨基葡萄糖聚合物的脱乙酰化过程。
- 壳聚糖水解是在壳聚糖酶的存在下发生的,壳聚糖酶破坏了β-葡萄糖胺单元之间由β-1,4-糖苷键连接的连接。
- 这种裂解导致壳二糖(氨基葡萄糖-(1-4)- β-氨基葡萄糖)的释放,然后被氨基葡萄糖酶进一步降解,得到氨基葡萄糖单位。
参考文献
- (2019)甲壳素:结构、化学和生物学。见:杨强,Fukamizo T. (eds)靶向含几丁质生物。《实验医学与生物学进展》,第1142卷。施普林格、新加坡。https://doi.org/10.1007/978-981-13-7318-3_2
- 壳聚糖及其在化妆品中的应用(英文)3月的药物.2019; 17(6): 369。2019年6月21日发布。doi: 10.3390 / md17060369
- Tharanathan RN, Kittur FS。甲壳素——无可争议的极具潜力的生物分子。食品科学。2003;43(1):61-87。DOI: 10.1080 / 10408690390826455。PMID: 12587986。
- Lenardon医学博士,Munro CA, Gow NA。几丁质合成与真菌发病机制。当今Microbiol.2010; 13(4): 416 - 423。doi: 10.1016 / j.mib.2010.05.002
- 几丁质和壳聚糖的制备与应用。Int J Adv Res(印多尔).2016; 4(3): 411 - 427。
- 等。几丁质酶:一个更新。美国医药生物联盟杂志.2013; 5(1):21-29。DOI:10.4103 / 0975-7406.106559
- Abhishek Singh Rathore,Rinkoo D.Gupta,“从细菌到人类的几丁蛋白酶:属性,应用和未来观点”,酶的研究,卷。2015年,第791907款,8页,2015年。https://doi.org/10.1155/2015/791907
- 甲壳素和壳聚糖的微生物降解机理。生物降解1,177 - 190(1990)。https://doi.org/10.1007/BF00058835。
来源
- 1%——https://www.sciencedirect.com/science/article/pii/S0038071708004288
- 1%——https://www.researchgate.net/profile/Malik_Mobeen_Ahmad/publication/236115053_Chitinases_An_update/links/0c96051af02e9c8f3f000000.pdf
- 1%——http://nopr.niscair.res.in/bitstream/123456789/29743/1/ijeb%2052%2811%29%201025 - 1035. - pdf
- < 1%, https://www.youtube.com/watch?v=pCowpxUsAN4
- < 1%, https://www.sciencedirect.com/topics/chemistry/chitosan
- < 1%, https://www.sciencedirect.com/science/article/pii/S0144861710004455
- < 1% - % 20 lesson.pdf https://www.sas.upenn.edu/ ~ caramboc /蛋白质
- < 1%, https://www.researchgate.net/publication/8173073_Chitinolytic_activity_of_filamentous_fungi
- < 1%, https://www.researchgate.net/publication/261031080_Hydrogenases
- < 1%, https://www.researchgate.net/publication/236115053_Chitinases_An_update
- < 1%, https://www.ncbi.nlm.nih.gov/pubmed/26542048
- < 1%, https://www.ncbi.nlm.nih.gov/pubmed/24095741
- <1% - https://www.ncbi.nlm.nih.gov/pmc/articles/pmc6097792/
- < 1%, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4926359/
- < 1%, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3551169/
- <1% - https://www.ncbi.nlm.nih.gov/pmc/articles/pmc2851747/
- <1% - https://www.mdpi.com/1422-0067/19/2/412/pdf-vor
- < 1%, https://ui.adsabs.harvard.edu/abs/2014BGeo...11.3339W/abstract
- < 1%, https://pubs.acs.org/doi/10.1021/acs.chemmater.8b05183
- < 1%, https://portlandpress.com/bioscirep/article/38/4/BSR2018032300/58006/Chitinase-diversity-limitations-and-trends-in
- < 1%, https://en.wikipedia.org/wiki/Chitin
- < 1%, https://edubuzznotes.com/hydrogen-bond/
- < 1%, http://europepmc.org/articles/PMC5094803

