表的内容
- 蛋白质的主要作用是充当酶,是生物化学反应的催化剂。
- 通过降低吉布斯自由活化能ΔG,使反应更容易达到过渡态。
- 许多酶催化反应的速率(v)可以用米歇里斯-曼腾方程来描述。
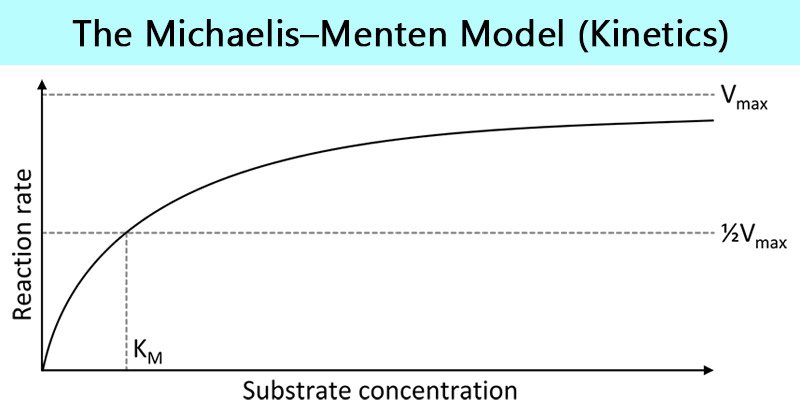
- 对于表现出米克利斯-曼腾动力学的酶,速度-底物浓度曲线是双曲线。
酶的速度
- 酶催化反应的速率通常称为酶的速度。
- 酶的速度通常以时刻0(初始速度,符号V)的值来报告o;μ摩尔分-1).
- 这是因为在任何底物转化为产物之前,底物浓度是最大的,在还没有产物的时候速率是最快的。
- 酶催化反应的产物随时间形成的典型曲线图显示了产物快速形成的初始阶段,这给出了曲线图的线性部分。
- 随着底物的消耗和/或酶失去活性,酶的速率就会减慢。
- V0从零时间点开始,通过曲线的线性部分绘制一条直线。这条直线的斜率等于V0.
底物和酶浓度
- 底物浓度([S])对酶速率的影响规律是:底物浓度较低时,[S]增加一倍,初始速率也增加一倍0).
- 然而,在较高的底物浓度下,酶变得饱和,进一步增加[S]导致V的微小变化0.
- 这是因为当底物浓度达到饱和时,所有的酶分子都与底物结合。
- 总的酶的速率现在取决于产物与酶分离的速率,添加更多的底物不会影响这个速率。当V0被绘制在[S]上称为双曲曲线。
- 在底物浓度饱和的情况下,酶浓度加倍会导致V的加倍0.这给出了V时的直线图0与酶浓度的关系。
Michaelis-Menten模型
- 米凯利斯-曼腾动力学是最著名的酶动力学模型之一。
- 它是以德国生物化学家利奥诺·米凯利斯和加拿大医生莫德·曼腾的名字命名的。
- 该模型采用方程式的形式,通过关联反应速率来描述酶的反应速率v(产物的生成速率[P])到[S],底物S的浓度。
- Michaelis-Menten模型使用了酶催化的以下概念:
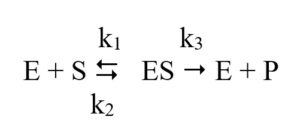
- 酶(E)与底物(S)结合形成酶-底物复合物(ES)。
- ES配合物可以再次解离形成E + S,或者通过化学反应生成E和产物P。
- 速率常数k1k2和k3.描述与催化过程的每一步相关的速率。
- 假设酶和产物(E + P)逆向反应转化为ES复合物的速率不显著。
- [ES]在几乎所有底物都被使用之前保持近似不变,因此在大多数反应过程中,ES的合成速率等于它的消耗速率;即[ES]保持稳态。
- 根据这个概念,米凯利斯-曼腾方程被推导出来:
Michaelis-Menten方程:
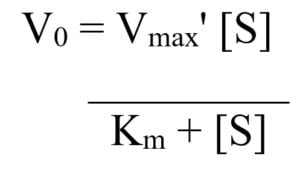
在那里,K米= (k2 + k3)/k1和V马克斯为最大速度。
米切里斯常数,Km,等于酶-底物复合物的分解速率除以它的形成速率的总和,是一种酶与底物亲和力的量度。
- 产物的生成速率(反应速度)与酶-底物复合物的浓度有关:
v = k3.[ES]
V马克斯当整个酶都在酶-底物复合物中时达到。
- K米v = 1/ 2v时底物浓度是多少马克斯.
当[S] = K米, K代换米对于[S],得到v = 1/2 Vmax。
- 当速度随[S]绘制时,就产生了双曲线。
参考文献
- 大卫·海姆斯和奈杰尔·胡珀(2005)。生物化学。第三版。泰勒和弗朗西斯集团:纽约。
- 史密斯,c.m.,马克斯,a.d.,利伯曼,m.a.,马克斯,d.b., &马克斯,d.b.(2005)。马克斯的基础医学生物化学:临床方法。费城:Lippincott Williams & Wilkins。

