表的内容
- 酶是生物大分子,又称生物催化剂,它在不发生任何变化的情况下加快生物化学反应的速度。
- 它是一种高选择性催化剂,大大加快了代谢反应的速率和特异性。
- 存在着许多类型的分子,它们能够干扰单个酶的活性。
- 任何直接作用于酶以降低其催化速率的分子被称为抑制剂。
- 有些酶抑制剂是抑制特定酶的正常身体代谢物,而其他抑制剂可能是外来物质,如药物或毒素。
- 这种抑制可能是一种途径的正常代谢控制的一部分,可能是一种疾病,也可能是一种治疗措施。
- 因此,酶抑制的效果可能是治疗性的,或者在另一个极端是致命的。
- 酶抑制可能有两种主要类型:
- 不可逆抑制作用
- 可逆的抑制
- 可逆抑制可进一步细分为:
- 竞争性可逆抑制和
- 非竞争性可逆抑制作用。
1.不可逆抑制作用
- 不可逆抑制剂与酶紧密结合并使其失活。
- 不可逆地与酶结合的抑制剂通常与活性位点或活性位点附近的氨基酸残基形成共价键,并永久地使酶失活。
- 敏感氨基酸残基包括Ser和Cys残基,它们分别具有反应性的-OH和-SH基团。
例子
- 化合物二异丙基磷酸氟酸酯(DIPF)是神经气体的一种成分,它与乙酰胆碱酯酶活性位点上的丝氨酸残基发生反应,不可逆地抑制酶,防止神经冲动的传递。
- 碘乙酰胺修饰Cys残基,因此可用作诊断工具,以确定酶活性是否需要一个或多个Cys残基。
- 抗生素青霉素不可逆地抑制糖肽转肽酶,这种酶通过共价连接到酶活性部位的丝氨酸残基,在细菌细胞壁中形成交联。
- 一种非特异性抑制剂以同样的方式影响所有的酶。非特异性抑制方法包括任何物理或化学变化,最终使酶的蛋白质部分变性,因此是不可逆的。
2.可逆的抑制
- 可逆抑制可以通过从酶中去除抑制剂来克服。
- 可逆酶抑制剂可分为竞争性酶抑制剂和非竞争性酶抑制剂,可通过Lineweaver-Burk图进行区分。
竞争性抑制剂
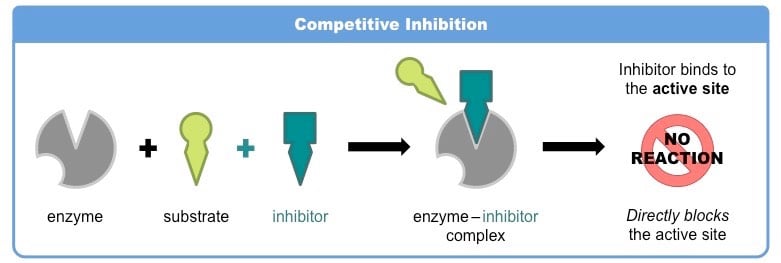
- 竞争性抑制剂与底物竞争酶的活性位点,形成酶-底物复合物。
- 竞争性抑制剂通常在结构上与酶的正常底物非常相似。因此,它与底物分子竞争结合到活性位点上。
- 由于酶可以结合底物分子或抑制剂分子,但不能同时结合底物分子和抑制剂分子;与抑制剂结合可抑制其活性。
- 竞争性抑制剂可逆地与活性位点结合。
- 在高底物浓度时,竞争性抑制剂的作用被克服,因为足够高的底物浓度将成功地竞争出抑制剂分子,使其与活性位点结合。
- 许多药物通过模仿目标酶的底物结构发挥作用,因此作为酶的竞争性抑制剂。
例子
琥珀酸脱氢酶是竞争抑制的一个很好的例子。该酶以琥珀酸酯为底物,被丙二酸酯竞争性抑制,而丙二酸酯与琥珀酸酯的不同之处在于它有一个而不是两个亚甲基
非竞争性抑制剂
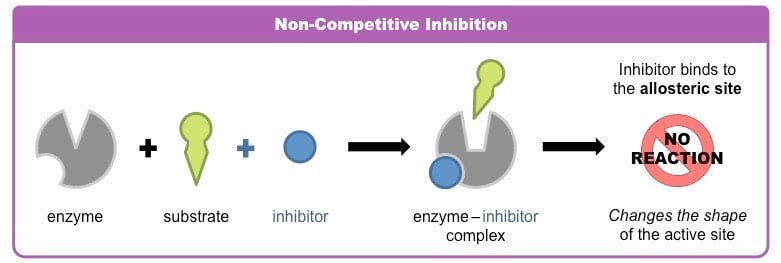
- 非竞争性抑制剂与酶或酶-底物复合物结合在与活性位点不同的位点上,降低酶的活性。
- 非竞争性抑制剂可逆地结合在活性位点以外的位点上,并引起酶的整体三维形状的改变,从而导致催化活性的降低。
- 由于抑制剂与底物结合的位点不同,酶可以将抑制剂、底物或抑制剂和底物结合在一起。
- 非竞争性抑制剂的影响不能通过增加底物浓度来克服,因此V下降马克斯.
- 非竞争性抑制的一个例子是蛋白酶抑素对酶肾素的作用。
参考文献
- Suzanne J. Baron和Christoph I. Lee(2013)。生物化学和遗传学。第二版。Mc Graw Hill:纽约。
- 大卫·海姆斯和奈杰尔·胡珀(2005)。生物化学。第三版。泰勒和弗朗西斯集团:纽约。
- 史密斯,c.m.,马克斯,a.d.,利伯曼,理学硕士,马克斯,d.b.,和马克斯,d.b.(2005)。马克的基础医学生物化学:一种临床方法。费城:利平科特·威廉姆斯和威尔金斯。
- Lehninger, a.l., Nelson, d.l., & Cox, m.m.(2000)。莱宁格尔生物化学原理。纽约:值得出版公司。

