在实验室建立了倒板法技术罗伯特•科赫自他的时代以来仍被广泛使用。该方法适用于兼性、微嗜氧和厌氧微生物。它简单、消耗资源少、简单、经济;然而,它要求样品处于液体或悬浮液中。
表的内容
什么是倒盘法?
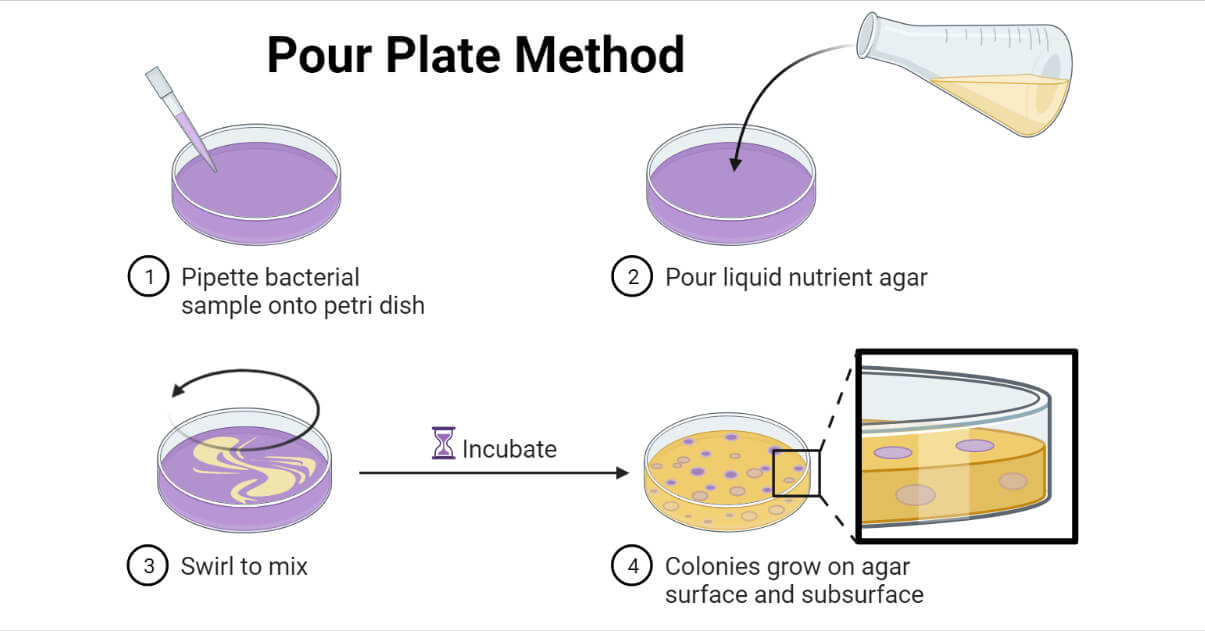
倒板法是一种微生物实验室技术,用于分离和计数存在于液体样品中的活微生物,该方法是在熔融琼脂培养基凝固前连同或在其之前加入的。
该技术通常用于通过计数固体培养基内部和/或表面上菌落形成单位(cfu)的总数来计数给定样品中的活微生物。主要用于细菌计数;然而,放线菌,霉菌和酵母也可以分离和枚举。
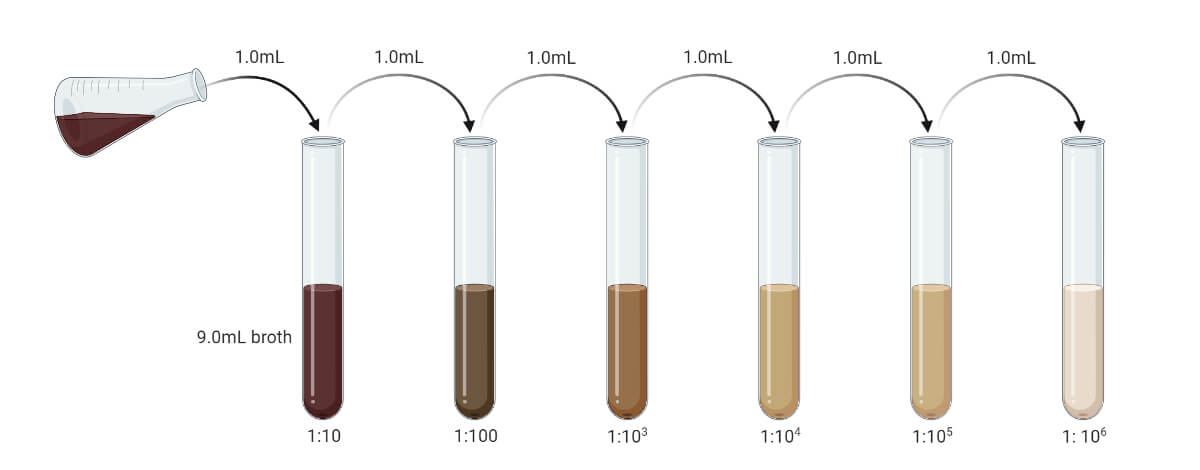
在进行倒板法之前,必须连续稀释样品,使样品中的微生物负荷在20 - 300 CFU/mL之间(适宜的菌落计数范围为20 - 200,有人认为为30 - 300,平均取25 - 250)。如果样品为液体,则可连续用无菌蒸馏水或无菌肉汤稀释。如果样品为固体或半固体,必须先将其乳化,然后连续稀释,以将微生物负荷降低到允许的范围内。
将样品添加到培养皿中,然后将熔融的琼脂培养基倒在其上,或者在倾倒前将样品与熔融的琼脂培养基混合。倒入培养皿后,必须迅速旋转培养皿,使样品与培养基适当混合。将混合培养基固化,在合适的条件下培养,培养样品中存在的微生物。
孵化之后,计算分离菌落的数量。如果菌落不可数或融合,或大于300 CFU/mL或小于20 CFU/mL,建议重复此过程以获得最佳计数。
浇注板的目标技术
- 从液体标本(或悬浮液)中分离微生物
- 通过每毫升菌落形成单位(CFU)计算活菌负荷
- 从混合群体中分离出微生物的纯培养物
- 分离分离菌落中的微生物,以研究菌落特性
原则倒板法
倒板法是基于这样一个事实:当混合了微生物的琼脂培养基被培养时,每一个活的微生物将繁殖形成一个单独的菌落。在这种方法中,一定体积的连续稀释的液体样品,通常为1ml,与大约15ml的40 - 45°C(小于50°C)的特定熔融琼脂培养基在培养皿中适当混合。培养基被允许凝固和培养,通常在37°C 24 - 48小时。培养后,样品中的活微生物将在培养基表面和内部生长成可见的菌落。可见菌落计数,CFU/mL计算公式如下;

需求倒盘法
- 液体样品(或固体样品的悬浮液)
对于倒板,样品必须是液体或悬浮形式。固体样品必须悬浮在合适的溶剂中,不影响任何微生物的生长,也不与任何介质材料发生反应。
- 合适的固体培养基
特异性培养基用于可疑(或特异性)细菌的分离和分化。培养基为固体琼脂培养基,经融化,温度为40 - 45°C。
- 佩特里盘子
通常使用10厘米的培养皿。他们必须是无菌的,必须在倒样品或培养基之前贴上标签。
- 试管》
样品制备过程中需要试管进行连续稀释。试管必须是无菌的。
- 无菌蒸馏水(或无菌肉汤)
蒸馏水或肉汤可用于连续稀释。它们也用于溶解固体或半固体样品。
- 微移液器(或分级移液器)
在连续稀释和样品接种过程中,需要0.1 mL或1ml容量的微管来测量样品。
- 其他实验室设施
过程倒板法
浇注板法的一般操作步骤可以总结如下:
1.整理好各项要求,穿戴好个人防护用品,对工作台面进行消毒,设置好实验室各类设备。
2.样品制备:
- 如样品为液体,需连续稀释,使微生物负荷范围为20 - 300 CFU/mL。(预先的试验可以给出准确的数值。你可以准备连续稀释多达10-10使用不同的稀释度)。
- 如果样品是固体或半固体形态,将其溶解在无菌蒸馏水或无菌肉汤中,或任何其他溶剂中。(一般1 gm样品与9 ml溶剂混合,得到浓度为10-1通用汽车/毫升)。
3.媒体准备:
- 准备合适的培养基(通用培养基,如细菌的营养琼脂和平板计数琼脂,以及真菌的马铃薯葡萄糖琼脂或Sabouraud葡萄糖琼脂)并进行高压灭菌。介质允许冷却到40 - 45°C(最高可达55°C),但不要让它固化。
- 如果介质已经准备好并凝固,将其放在水浴或其他热源上融化。
- 如果你想在将样品倒入培养皿之前将其混合在培养基中,你可以在一个试管或烧杯中加入大约15毫升的培养基,然后用高压灭菌器将其灭菌。或者,可以在大烧杯或瓶子中准备固定体积的培养基,然后通过计算体积来添加样品,这相当于每15毫升培养基中添加1毫升样品。
4.摆放无菌培养皿。在平板底部边缘贴上标签,注明稀释因子、日期、名称、样品ID和其他所需信息。
5.接种:
方法,我
使用无菌微管或校准移液器在培养皿中心分配1ml稀释样品。
打开瓶盖,点燃瓶口。在样品上方的适当温度下倒入约15毫升灭菌的熔融介质。
盖上培养皿的盖子,然后通过轻轻地旋转培养皿将样品适当地混合在介质中。盘子通常以“S”或“8”形旋转。
(将特定稀释倍数的样品放入标有特定稀释倍数的板中。)
方法——二世
在一个含有大约15毫升熔融介质的试管中,在合适的温度下,加入1毫升样品。将样品适当地混合在介质中。将培养基倒入无菌培养皿中。
6.盖上培养皿的盖子。让媒体完全固化。
7.在合适的孵育条件下倒置孵育板(主要在37°C下孵育24小时)。
结果解释倒板法
- 孵化后,观察到发育的菌落。每个菌落将占一个活的微生物细胞或一个菌落形成单位。
- 如果所有菌落都是同一类型,那么我们可以预测样品中只包含一种微生物属。然而,可能有不同的属或种产生相似类型的菌落。因此,需要进一步测试他们的身份。
- 如果菌落的形态不同,那么我们可以得出结论,该样本包含一个混合种群。它们可以通过使用条形平板法在单独的培养皿上传代培养每个菌落来纯化。
- 计数菌落,计算CFU/mL:

这将给出给定样本中存在的存活微生物细胞的总数。
- 为了达到最佳计数,菌落数量必须在20 - 300 CFU/mL之间。超过这个限度,整个过程必须重复。当菌落数小于20时,建议使用低稀释倍数的样品;当菌落总数超过300时,建议连续重复使用高稀释倍数的样品。
- 如果菌落融合或整个培养皿被单个菌落覆盖,则报告为“数不清”(TNTC),并在更高的稀释倍数下重复取样过程。
预防措施在倾注平皿技术
- 遵循适当的安全规程。将每一个未知或临床标本视为危险标本,并遵循相应的安全措施。
- 使用的每个培养皿和培养基都必须是无菌的。工作环境必须无菌。
- 用于连续稀释或溶解固体样品的水或介质必须是无菌的。
- 用于溶解固体样品的溶剂必须是无菌的,不能对任何微生物有任何生长支持或抑制作用。
- 样品必须被足够的稀释,使活微生物负荷落在20 - 300 CFU/mL之间。在这个范围以上,很难计算蜂群数量,而且蜂群可能会融合在一起。低于这个范围,结果被报告为不显著。如果菌落计数低于20 CFU/mL或高于300 CFU/mL,在相同条件下必须重复此过程。
- 在连续稀释和培养基配制过程中,准确的测量是必须的。
- 在培养皿或介质管或瓶中转移样品时,使用微移管或标准校准管。
- 美国FDA允许的培养基体积为每10cm培养皿12 - 15ml,而USP允许的体积为每10cm培养皿15 - 20ml。
- 样品在凝固前必须与熔融的琼脂适当混合。
- 在浇注或与样品混合时,介质的温度是非常重要的。它必须在40 - 45之间0C (550C是最高温度,无论如何不能超过这个温度)。温度在40度以下0不建议使用C,因为培养基会凝固或结块。
- 每个培养皿必须在倒入培养基和样品之前贴上标签。必须有稀释系数的标注。在分配样品时,必须检查标签,稀释系数的信息必须与样品的浓度相匹配。
应用程序倾板技术
- 用于从悬浮液或液体样品中分离和枚举活菌和真菌(计算CFU/ml)。
- 用于食品、制药等行业,用于水、饮料、食品、组织样品等原料和产品的微生物分离和cfu计算。这将有助于质量控制,以确保产品是否安全消费。
- 用于从土壤中分离和计数微生物,研究土壤微生物区系。
- 用于生成生长曲线,同时研究微生物代谢和生化特征,以及环境因素对微生物生长的影响。
- 用于分离菌落以获得纯培养和研究生化特性。
- 用于将纯文化从混合文化中分离出来。
优势倾板技术
- 操作简单,不需要额外的接种工具和材料。
- 不需要预先固化的琼脂培养基。
- 接种时不要有刮伤的风险,就像刮伤和蔓延一样。
- 即使是非常低的微生物负荷也能检测到。
- 随着微生物的分离,可以得到它们的分离菌落。计算CFU/mL的数量。
- 它可以使用任何类型的样本,如临床或环境样本,液体或固体(它可以溶解)。
- 适用于兼性微生物和厌氧微生物的分离。该方法也可分离出需氧菌。
限制倒板技术
- 固体或半固体样品在孕育前必须悬浮。如果样品不容易溶解,那就很难。
- 需要对样品进行连续稀释,否则会形成太多的菌落,无法计数或识别为离散的。
- 在40-45°C时,热敏性生物会受到熔融介质的影响。
- 生物的生长和菌落的形成需要一定的时间。在固化培养基的底部,微生物细胞的氧气供应会减少,因此生长缓慢。
- 蜂群可能比裸奔或分散时小,这增加了俯瞰它们的机会。
- 专性需氧菌在盘子底部生长可能会遇到困难。有些甚至不生长。
- 该方法需要溶解固体样品,连续稀释,并在一定温度(42 - 45°C)下熔化介质,耗时较长。
参考文献
- Sanders E. R.(2012)。无菌实验室技术:电镀方法。可视化实验杂志:JoVE, e3064(63)。https://doi.org/10.3791/3064
- 微生物学与免疫学教材(2012),2nd版本。Subah钱德拉Parija。ISBN: 978-81-312-2810-4
- 微生物学实用手册,2nd版。由伊曼纽尔·戈德曼和劳伦斯·h·格林编辑。CRC出版社。泰勒和弗朗西斯集团,6000破声公园大道西侧,300号套房。破碎之声公园大道西侧6000号,300号套房。
- VAN Soestbergen, a.a., & Lee, c.h.(1969)。倒盘子还是条纹盘子?应用微生物学,18(6), 1092 - 1093。https://doi.org/10.1128/am.18.6.1092-1093.1969
- 第三章:有氧平板计数| FDA
- |培养方法中微生物分离的倒板技术
- 倒盘法:原理,程序,用途和限制- BIOCHEMINSIDER
- 倒盘法原理、程序、目的、结果、优点
- 倒盘法原理、程序、目的、结果、优点
- 本森的微生物应用,一般微生物学实验室手册,第13版。MC Graw山。
- 倒盘法:程序,用途,(缺点)优点•微生物在线
- 倒盘法最佳实践- Microbiologics博客
- Maturin L.和Peeler J. T. 2001。FDA细菌学分析手册。第三章,有氧平板计数。
- 美国药典,2013。<61>,非无菌产品微生物检验:微生物计数试验
- 培养基准备:平板浇注法- Alliance Bio -expertise.com
- 获得微生物纯培养:6种方法(biologydiscussion.com)


我现在在Instagram上看到了一个关于这种技术的直播,我想了解更多。这个解释太棒了,帮了我很多!!感谢分享!
亲爱的先生
我有一个问题,我在一家制药公司工作。我们研制了头孢克肟口服混悬剂。
先生,请指示我为倒板法准备样品溶液。
这很简单,兄弟,练习一下
谢谢
令人印象深刻的